Последние добавленные статьиГлава 4. Сжимаемость Глава 4: Сжимаемость Одно из самых простых физических явлений – сжатие. Это реакция равновесия региона времени на внешние силы, действующие на него. При наличии уже имеющейся информации сейчас мы можем начать исследование сжатия твердых тел, не обращая внимания на вопрос происхождения внешних сил. Для этой цели мы вводим концепцию давления, которое определяется как сила на единицу площади.
Во многих случаях будет удобно иметь дело с давлением на основе объема, а не площади. Поэтому, мы умножаем и силу, и площадь на расстояние s, что дает альтернативное уравнение:
В области вне единицы расстояния, где атомы или молекулы материи независимы, общая энергия совокупности может быть выражена в терминах давления и объема как
Как мы обнаружим в следующей главе, когда начнем рассмотрение термальных движений, условие постоянства температуры – это условие постоянства энергии, если все остальное равно. Тогда уравнение 4-3 говорит следующее. У совокупности, у которой силы сцепления между атомами или молекулами незначительны (идеальный газ), объем при постоянной температуре обратно пропорционален давлению. Это Закон Бойля - одно из самых хорошо обоснованных отношений физики.В соответствии с ранее установленным общим межрегиональным отношением, в целях применения в регионе времени, в котором пребывает равновесие твердых тел, вторая степень объема должна заменяться первой степенью. Поэтому, эквивалент Закона Бойля в регионе времени таков:
В терминах объема он становится
Это уравнение говорит, что при постоянной температуре объем твердого тела обратно пропорционален квадратному корню давления. Давление, представленное символом Р в этом уравнении, является, конечно, общим действующим давлением. Сила, возникающая за счет последовательности естественной системы отсчета, противоположна силам вращения и действует параллельно внешним силам сжатия, но имеет ту же величину независимо от того, присутствуют ли внешние силы или нет. Следовательно, она оказывает то, что мы можем назвать внутренним давлением, уже существующим уровнем давления, к которому прибавляется внешнее давление. Чтобы соответствовать установленному использованию и избежать путаницы, отныне символ Р будет относиться только к внешнему давлению, а общее давление будет выражаться как P0 + P. На этой основе уравнение 4-5 будет выглядеть как
Обычно, сжатие выражается в терминах относительных, а не абсолютных объемов. Нулевой уровень объема при нулевом внешнем давлении превращает уравнение 4-6 в форму
При делении уравнения 4-6 на уравнение 4-7 и переставляя, мы получаем
Как показывает это уравнение, внутреннее давление P0 – ключевой фактор при сжатии твердых тел. Ввиду того, что оно является результатом последовательности естественной системы отсчета, которая в регионе времени несет атомы вовнутрь, противоположно силам их вращения (гравитации), сила, направленная вовнутрь, действует только в двух измерениях (областях). Следовательно, величина давления зависит от ориентации атома в связи с линией последовательности. Как указывалось в связи с выводом межрегионального отношения, в регионе времени имеются вероятные положения единицы смещения 156,44. Здесь часть az представляет площадь, подвергаемую давлению, где a и z являются действующими смещениями в активных измерениях. Буквенные символы a, b и с используются так, как указано в главе 10 тома 1. Смещение z – это либо электрическое смещение с, либо второе магнитное смещение b, в зависимости от ориентации атома.Из принципа эквивалентности естественных единиц следует, что каждая естественная единица давления оказывает одну естественную единицу силы на единицу площади поперечного сечения на действующую единицу вращения в третьем измерении эквивалентного пространства. Однако давление измеряется в единицах, применимых к влиянию внешнего давления. Вовлеченные в давление силы распределяются в трех пространственных измерениях и в двух направлениях в каждом измерении. В структуре региона времени, силы действуют в одном направлении одного измерения, то есть 1/6 суммы сил. Применяя коэффициент 1/6 к отношению az 156,444, для внутреннего давления на единицу вращения при единичном объеме мы имеем
Сейчас это уравнение можно распространить на y единиц вращения и V единиц объема следующим образом:
Сила, действующая за счет последовательности естественной системы отсчета, не зависит от геометрической компоновки атомов, и термин “объем” в уравнении 4-10 относится к тому, что мы можем назвать трехмерным атомным пространством, кубу межатомного расстояния, а не геометрическому объему. Поэтому, мы заменим V на S03. Это дает нам уравнение внутреннего давления в конечной форме:
Выведенная из этого уравнения величина – это величина внутреннего давления в терминах естественных единиц. Чтобы получить давление в терминах любой традиционной системы единиц, необходимо лишь применить числовой коэффициент, равный величине естественной единицы давления в этой системе. Соответствующие величины в системах единиц, используемых в сообщениях об экспериментах, с которыми будут сравниваться величины в этой главе, таковы:
1.554 x
107 атм В терминах единиц, используемых П. У Бриджменом, пионером-исследователем в этой области, в большинстве его трудов, уравнение 4-11 принимает вид
Таким образом, внутреннее давление, вычисленное для какого-то конкретного вещества, не обязательно постоянно во всей области внешнего давления. При общих низких давлениях, ориентация атома в связи с линией последовательности естественной системы отсчета определяется термальными силами, которые, как мы увидим позже, благоприятствуют минимальным величинам действующей области поперечного сечения. Поэтому в низкой области общих давлений поперечное сечение настолько мало, насколько позволят смещения вращения атома. Согласно Принципу Шателье, более высокое давление, либо внутреннее, либо внешнее, приложенное к равновесной системе, заставляет ориентацию сдвигаться (одним или более шагами) к более высоким величинам смещения. При сверхвысоком давлении сжимающая сила, действующая на максимальное поперечное сечение, составляет 4 магнитных единицы в одном измерении и 8 электрических единиц в другом. Аналогично, при низких давлениях лишь одна из магнитных единиц вращения в атоме участвует в радиальной компоненте (вектора) y сопротивления сжатию. Но дальнейшее повышение давления расширяет участие на дополнительные единицы вращения, и при сверхвысоких давлениях участвуют все единицы вращения атома. Следовательно, ограничивающая величина y – это общее число таких единиц. Точная последовательность, в которой эти два вида факторов увеличиваются в промежуточной области давления, еще не определена. Но для нынешних целей решение этой проблемы не обязательно, поскольку влияние любого конкретного увеличения одинаково в обоих случаях.Первые два из инертных газов, гелий и неон, элементы, не обладающие действующим вращением в электрическом измерении, принимают абсолютный минимум коэффициентов сжатия: одна единица вращения с одной действующей единицей смещения в каждом из двух действующих измерений. Коэффициенты azy для этих элементов можно выразить как 1-1-1. В этом обозначении, которым мы будем пользоваться для удобства в последующем обсуждении, числовые величины коэффициентов сжатия даны в том же порядке, что и в уравнениях. Следует заметить, что абсолютный минимум сжатия, применимый к элементам самого низкого смещения, точно определяется коэффициентами 1-1-1. У более высоких членов класса инертного газа величина коэффициента увеличивается за счет большего магнитного смещения.Из-за отрицательного смещения в электрическом измерении, которое в этом контексте эквивалентно нулевому смещению инертных газов, электроотрицательные элементы следуют паттерну инертного газа. Они принимают коэффициенты 1-1-1 у самых низких членов самых низких групп вращения, и величины выше, но все еще ниже тех, которые соответствуют электроположительным элементам, поскольку смещение увеличивается либо в одном, либо в двух атомных вращениях. Ни один из элементов электроотрицательных делений ниже электрического смещения 7 изначально не обладает коэффициентами az 4-8, хотя они стоят этих высоких уровней и, в конце концов, могут достигать их при надлежащих условиях.Все электроположительные элементы, изученные Бриджменом, обладают полными 4-мя единицами в одном измерении; то есть, а = 4. Величина коэффициента z у щелочных металлов равна электрическому смещению одной единицы, и поскольку при низких давлениях y принимает минимальную величину, коэффициенты сжатия для этих элементов представляют 4-1-1. Смещение двухвалентных элементов (кальций и так далее) принимает величины 4-2-1 или 4-3-1. Большие смещения элементов следуют эффекту удвоения. Они увеличивают внутренне давление посредством увеличения действующего поперечного сечения. Большее внутренне давление оказывает тот же эффект, что и большее внешнее давление, вызывая дальнейшее увеличение коэффициентов сжатия. Следовательно, большинство элементов пользуется полными смещениями активных измерений поперечного сечения с начала сжатия; то есть, 4-4-1 (az – ab, два магнитных измерения) у некоторых элементов низких групп и переходных элементов Группы 4А, и 4-8-n (az = ac, одно магнитное и одно электрическое измерение) у других.Коэффициенты, определяющие внутренние давления соединений, исследованные до сих пор, в основном пребывали в промежуточной области, между 4-1-1 и 4-4-1. Например, NaCl сначала имеет коэффициенты 4-2-1 и сдвигается до 4-3-1 в области давления между 30 и 50 м кг/см2, AgCl сначала имеет 4-3-1 и повышает эти коэффициенты до точки перехода около предела давления Бриджмена – 100 м кг/см2 . CaF2 обладает коэффициентами 4-4-1 с самого начала сжатия. Первичные величины внутреннего давления большинства исследованных неорганических соединений основаны на том или ином из трех паттернов. У органических соединений эти величины в основном 4-1-1, 4-2-1 или промежуточная величина 4-1½-1.Сжатие обычно измеряется в терминах относительного объема, и большая часть обсуждения в этой главе будет происходить на этой основе. Но для других целей нас будет интересовать сжимаемость - скорость изменения объема под давлением. Скорость получается дифференцированием уравнения 4-8.
Особый интерес вызывает начальная сжимаемость P0. Для всех практических целей она совпадает с сжимаемостью под действием давления в одну атмосферу; такое давление является лишь небольшой частью внутреннего давления P0. Начальная сжимаемость может быть получена из уравнения 4-13 с помощью принятия Р равным нулю. Результат:
Поскольку начальная сжимаемость – измеряемая величина, ее простое и непосредственное отношение к внутреннему давлению обеспечивает значимое подтверждение физической реальности этого теоретического свойства материи. Коэффициенты начальной сжимаемости, теоретически выведенные для элементов, величины сжимаемости которых доступны для сравнения, внутренние давления, вычисленные из этих коэффициентов, и начальные сжимаемости, соответствующие вычисленным внутренним давлениям, приводятся в таблице 14, наряду с измеренными величинами начальной сжимаемости при комнатной температуре. Приводятся два набора экспериментальных величин, один от Бриджмена, второй из более поздней подборки. Величины S03, за исключением помеченных звездочками, вычислены на основании внутриатомных расстояний, (S0), приведенных в таблицах главы 2. Там, где структура неоднородна, показанная величина S03 является произведением одного из расстояний на квадрат другого. Причина наличия отклонений от величин главы 2 будет объясняться позже. Таблица 14: Начальная сжимаемость
В большинстве случаев разница между вычисленными и измеренными сжимаемостями пребывает в пределах вероятной ошибки эксперимента. Значимые отклонения от вычисленных величин ожидаются в случае элементов с низкими точками плавления, таких как щелочные металлы, до тех пор, пока в эмпирические данные не вносятся коррекции, поскольку в начальном объеме таких веществ имеется дополнительный компонент. Везде, где имеется разница между вычисленными сжимаемостями и любым из двух наборов экспериментальных данных, в среднем, она не больше, чем разницы между экспериментальными результатами. Этот процесс повторяется и на последовательно высоких уровнях давлений до тех пор, пока не достигнет максимальных коэффициентов сжатия.Из-за природы паттерна сжатия, удобный метод анализа экспериментальных величин объема различных соединений при сжатии доступен посредством выражения уравнения 4-8 в форме
Согласно этому уравнению, если мы графически изображаем обратные величины квадратов относительных объемов на соответствующих общих отношениях давления, мы получаем прямую линию, пересекающуюся с ординатой нулевого давления в точке объема, равного 1,00. Наклон линии определяется величиной внутреннего давления, P0. Рис.1 (a) является кривой такого вида для элемента олова, основанной на экспериментальных величинах Бриджмена.Там, где в экспериментальной области происходит переход к более высокому набору коэффициентов сжатия, и величина P0 меняется, объемы отклоняются от оригинальной линии и следуют второй прямой линии, наклон которой определяется новыми коэффициентами сжатия. На подготовленных кривых такого вида для других элементов, исследованных Бриджменом, мы находим, что около 2/3 этих линий действительно согласуются с одной прямой линией вплоть до предела давления в 30.000 кг/см2 в его ранней работе. Изучения менее сжимающихся веществ, таких как более высокие элементы электроположительных делений, не проводились выше этого уровня. Он измерял сжатие вплоть до 100.000 кг/см2 у многих других элементов. Обнаружилось, что большинство из них подвергается переходу, при котором действующее внутреннее давление увеличивается без нарушения непрерывности объема. Кривая сжатия для такого вещества состоит из двух сегментов прямой линии, связанных плавной кривой перехода, как на Рис. 1(b), который представляет величины Бриджмена для кремния. Рисунок 1: Паттерны сжатия
(а) олово; (b) кремний; (с) хлорид калия; (d) сурьма Кроме изменений такого типа, обычно называемых переходом второго порядка, некоторые твердые вещества подвергаются переходам первого порядка, когда в точке перехода происходит модификация кристаллической структуры и прерывности объема. В период перехода такого вида обычно меняется действующее внутреннее давление и результирующий паттерн объема похож на паттерн KCl, Рис. 1(с). За исключением некоторых величин, ошибочных и сомнительной надежности, все результаты Бриджмена следуют одному из трех паттернов или их комбинации. Паттерн сурьмы, Рис. 1(d), демонстрирует один из комбинированных паттернов. Здесь за переходом второго порядка между 30.000 и 40.000 кг/см2 следует переход первого порядка при высоком давлении. Числовые величины, соответствующие этим кривым, приводятся в нижеприведенных таблицах.Экспериментальные кривые второго порядка плавные и правильные, указывая на то, что при достижении надлежащего давления, процесс перехода происходит свободно. Напротив, переходы первого порядка демонстрируют значительную неправильность, и экспериментальные результаты позволяют предположить, что у многих веществ структурные изменения в точках перехода подвергаются переменному количеству задержки за счет внутренних условий в твердой совокупности. У таких веществ переход совершается не при определенном давлении, а где-то в пределах относительно широкой зоны перехода, и между измерениями, точный процесс перехода может значительно меняться. Кроме того, имеется много веществ, подвергающихся подобным задержкам в достижении объемного равновесия даже без перехода. Кривые сжатия позволяют предположить, что ряд зафиксированных переходов на самом деле является подгонками объема, отражающими задержку реакции на приложенное ранее давление. Например, на кривой бария, основанной на результатах Бриджмена, имеются два перехода, один между 20.000 и 25.000 кг/см2, и другой между 60.000 и 70.000 кг/см2. И все же, экспериментальные объемы при 60.000 и 100.000 кг/см2 очень близки к величинам, вычисленным на основе отношения прямой линии. Поэтому весьма вероятно, что этот элемент действительно следует одному линейному отношению, по крайней мере, поблизости от 100.000 кг/см2.Отклонения от теоретических кривых, обнаруженные в экспериментальных объемах веществ с относительно высокими точками плавления, обычно пребывают в пределах ошибки эксперимента, и в большинстве случаев большие отклонения можно объяснить на вышеизложенной основе. Кривые сжатия для веществ с низкими точками плавления демонстрируют систематические отклонения от линейности при низких давлениях, но это нормальный паттерн поведения, возникающий в результате близости изменения состояния. Как будет детально изложено в исследовании жидкого состояния, физическое состояние материи – это, в основном, свойство индивидуального атома или молекулы. Состояние совокупности отражает состояние большинства ее индивидуальных составляющих. Соответственно, твердая совокупность при любой температуре ближе к точке плавления содержит конкретную пропорцию жидких молекул. Поскольку объем жидких молекул отличается от объема твердых молекул, соответственно меняется объем совокупности. Величина отклонения объема в любом случае может быть вычислена посредством методов, которые будут описаны в последующем обсуждении в связи с объемом жидкости.Таблица 15 сравнивает результаты применения уравнения 4-8 с измерениями Бриджмена некоторых элементов, поддерживающих одно и то же внутреннее давление вплоть до предельного давления 100.000 кг/см2. Во многих случаях он выполнял несколько серий измерений для одного и того же элемента. Большинство результатов согласуются в пределах 0,003, и не представляется, что перечисление всех индивидуальных величин в таблицах служило бы какой-то полезной цели. Величины, приведенные в таблице 15 и аналогичных последующих таблицах, получены в результате экспериментов, выполненных на уровне давления 100.000 кг/см2. Там, где измерения при высоком давлении начинались с какого-то поднятого давления, или там, где интервал измерения больше обычного, промежутки заполняются результатами экспериментов Бриджмена. Таблица 15: Относительные объемы под давлением
Таблица 16 распространяет сравнения объема на элементы тех классов, которые подвергаются переходам внутри экспериментальной области давлений. Переходы, зафиксированные исследователем или указанные теоретическими вычислениями, подчеркнуты горизонтальными линиями в надлежащих колонках. В этих таблицах положение верхней ветви каждой кривой зафиксировано использованием экспериментального объема при выбранном давлении в сегменте прямой линии над переходом (обозначено символом R) как точка отсчета. Следовательно, наклон верхней ветви кривой определяется теоретически, но положение, относительно шкалы 1/V2 эмпирическое. Проделана определенная работа по расширению теоретического развития до определения точного положения верхней секции каждой кривой, но этот проект недостаточно продвинулся, чтобы сейчас заслуживать обсуждения. Таблица 16: Относительные объемы под давлением
Паттерны сжимаемости соединений теоретически идентичны паттернам элементов. Этот теоретический вывод подтверждается данными сжатия для группы неорганических соединений, приведенными в таблице 17. Таблица 17: Относительные объемы под давлением
Как можно было бы ожидать для менее однородного состава, переходы более обычны у соединений, в противном случае, в кривых сжатия нет разницы. Кривая для KCl, графически изображенная на Рис. 1 и численных величинах в Таблице 17, вызывает особый интерес, потому что включает резкий переход первого порядка, при котором происходит значительное уменьшение базового объема, в то время как коэффициенты сжатия остаются неизменными. Величина уменьшения объема, которое имеет место, указывает на наличие переориентации атомных вращений, при котором нейтральное удельное электрическое вращение 5 заменяется обычным вращением 4 как действующей относительной величиной. Как показано в таблице, теоретические объемы за пределами точки перехода основаны на маленьком атомном объеме, соответствующем более высокому вращению. Вплоть до 20.000 кг/см2, объем следует кривой, соответствующей коэффициентам сжатия 4-2-1 и S03 = 1,222, что создает внутреннее давление 112,7 м кг/см2. В точке перехода базовый объем (S03) падает до 0,976. увеличивая внутреннее давление до 141,1 м кг/см2. Затем, сжатие продолжается на этой основе вплоть до 45.000 кг/см2, где коэффициенты сжатия меняются с 4-2-1 до 4-3-1; соответственно повышается внутреннее давление.Как и при сжатии элементов, теоретические вычисления не всегда соответствуют переходам, зафиксированным экспериментаторами. С другой стороны, вычисления показывают, что большая часть соединений, включая шесть из восьми в Таблице 17, подвергается либо переходу, либо какому-то другому процессу, при котором они убирают компонент объема в области давления ниже 5.000 кг/см2. Влияние на эффект сжатия вынуждает линейный сегмент кривой пересекаться с ординатой нулевого давления при объеме ниже 1,000. Происхождение таких корректировок объема до сих пор не ясно. Наличие ряда наблюдаемых переходов первого порядка при относительно низких давлениях позволяет предполагать, что могут иметь место и ранние переходы второго порядка. Также, возможно, что пустоты в структуре могут устраняться на ранних стадиях сжатия, или что имеются геометрические подгонки.Структурные характеристики органических соединений делают их особо чувствительными к таким геометрическим подгонкам. Из-за низких точек плавления, их объемы под низким давлением тоже включают дополнительный компонент, существующий перед самим изменением состояния. Однако представляется, что в обширной области соединений устранение лишних компонентов объема существенно завершается при каком-то давлении, гораздо ниже уровня 40.000 кг/см2, на котором выполнены измерения Бриджмена для твердых органических соединений. Это говорит о наличии довольно широкой области, в которой эти соединения следуют обычному паттерну сжатия. Нижеприведенное сравнение теоретических и наблюдаемых отношений объема у бензола и некоторых его полимеров указывает на то, как развивается устранение лишнего объема. То, что измеренное отношение ниже теоретического, означает, что избыточный объем устраняется в области давления, в которой измерено отношение. А величина разницы – это величина, на которую уменьшается нормальный объем за счет увеличения сжатия.Как показывают цифры, бензол освобождается от избыточного объема на пределе давления экспериментов. У кривой сжатия бензола нет линейного сегмента, на котором можно измерить наклон для сравнения с теоретической величиной. Однако при увеличении сложности молекул линейный сегмент кривой удлиняется, и у соединений типа антрацена имеется интервал 15.000 кг/см2, в котором измеряемые объемы должны следовать теоретической линии.
Соединения такой природы обладают магнитным вращением 3-3 и электрическим вращением 4. Следовательно, действующая величина S03 составляет 0,812, а коэффициенты сжатия 4-1½-1 создают результирующее внутреннее давление 127,2 м кг/см2. Как показано величинами таблицы для бензола, вычисленными на основе внутреннего давления, отношение объема при 40.000 кг/см2 к объему при 25.000 кг/см2 должно составлять 0,954 для всех органических соединений с характеристиками (сложностью молекул, точкой плавления, коэффициентами сжатия и так далее), похожими на характеристики антрацена. Таблица 18 показывает, что данный теоретический вывод подтверждается измерениями Бриджмена. Таблица 18: Измеренное отношение объема - 40/25 M/кг/см2(Теоретическое отношение: 0,954)
К моменту первых вычислений теоретических величин в вышеприведенных таблицах результаты Бриджмена представляли собой почти все экспериментальные данные, доступные в области высокого давления; а его экспериментальный предел 100.000 кг/см2 был границей эмпирического знания о влиянии высокого давления. Последующее развитие техники шоковой волны американскими и русскими исследователями позволило измерение сжатий под давлениями вплоть до нескольких миллионов атмосфер. При наличии новых измерений мы можем расширить корреляцию между теорией и экспериментом в область максимальных коэффициентов сжатия. Природа реакции коэффициентов сжатия на давление уже объяснена; также определены максимальные коэффициенты для каждой группы элементов. Однако величина базового объема (S03) тоже входит в определение внутреннего давления, и наряду с увеличением коэффициентов имеется тенденция минимального базового объема. Сами по себе модификации кристаллической структуры играют лишь небольшую роль в картине сжимаемости. Применение достаточного давления вынуждает твердое тело принимать одну из кристаллических форм, соответствующих самой тесной упаковке атомов - гранецентрированную кубическую форму или тесно упакованную шестиугольную форму для однородных кристаллов и самые эквивалентные структуры, если кристаллы неоднородны. Если при нулевом давлении существует какая-то другая кристаллическая форма, уменьшение объема за счет изменения в сторону одной из тесно упакованных форм проявляется как процентное уменьшение всех последующих объемов, но это не влияет на сжимаемость. Однако разница в кристаллической структуре часто указывает на разницу в относительной ориентации атомных вращений. Любое изменение в ориентации изменяет внутреннее давление и, следовательно, оказывает значимое влияние на сжимаемость. Применение давления благоприятствует тому, что можно назвать “правильными” структурами, за счет тех структур, которые могут существовать только благодаря особым условиям, связанным с конкретными вовлеченными элементами. Эта тенденция очевидна с начала процесса сжатия. Именно она отвечает за большое число отклонений от величин Таблицы 2 межатомных расстояний, обозначенных звездочками в таблице 14. Например, пять элементов, от хрома до никеля, обладают разными межатомными расстояниями при низком давлении и могут кристаллизоваться в альтернативных формах. Однако на ранних стадиях сжатия все эти элементы, за исключением марганца, ориентируются на основе нейтрального относительного вращения 10 и обладают внутренним давлением, отражающим соответствующую величину S03, равную 0,603. При более высоких давлениях ванадий сдвигается к тому же относительному вращению и образует группу. Марганец, возможно, делает то же самое, но эмпирическое подтверждение этого изменения все еще отсутствует. Следовательно, изменение разнообразия атомных компоновок сильно уменьшается за счет внутреннего давления. Одним из сопутствующих влияний является то, что неопределенность в определении ориентации вращения и результирующий базовый объем минимальна. Большинство элементов, меняющихся до нижнего базового объема в начале сжатия, сохраняют новую величину S03 в течение оставшейся нынешней области экспериментов шоковой волны. Элементы, не совершающие такого изменения на ранних стадиях сжатия, обычно делают это при более высоком давлении. И лишь немногие сохраняют один и тот же базовый объем вплоть до предела давления шоковой волны. Таким образом, общий паттерн включает одно уменьшение базового объема в области давления от нулевого внешнего давления вплоть до предела экспериментов шоковой волны. Этот паттерн отражается в двенадцати сериях измерений, выбранных для сравнения с теоретическими величинами. Из двенадцати включенных элементов лишь два, медь и хром, имеют тот же базовый объем в области шоковой волны, что и при нулевом давлении. Четыре элемента продолжают с величин S03, применимых к ранним стадиям сжатия, величинам, приведенным в Таблице 14, и шесть элементов меняются до более низкого базового объема где-то выше предела давления Бриджмена. В Таблице 19 показаны минимальные базовые объемы, соответствующие максимальные коэффициенты сжатия и результирующие внутренние давления для этих элементов. Таблица 19: Максимальные внутренние давления
Здесь, вновь, как и в области давления экспериментов Бриджмена, теоретическое развитие еще недостаточно продвинулось для того, чтобы позволить определение точных положений верхних сегментов кривых сжатия. Во всех случаях неясно, сколько возможных промежуточных величин коэффициентов сжатия действительно задействовано при увеличениях давления. На современной, достаточно ранней стадии развития теории, все, что мы можем сделать, - это продемонстрировать следующее. При крайне высоких и крайне низких давлениях объем меняется обратно пропорционально квадратному корню из общего давления, точно в соответствии с теорией. В этой связи следует заметить, что сегмент кривой каждого сжатия, основанный на максимальной величине внутреннего давления, достаточно длинен, чтобы сделать паттерн квадратного корня явным и различимым. Кроме того, мы можем показать, что наклон последнего сегмента экспериментальной кривой для каждого элемента идентичен теоретическому наклону, определенному с помощью вычисленных максимальных величин внутреннего давления, и что наклон каждого из промежуточных сегментов согласуется с одной из возможных промежуточных величин внутреннего давления. Точному теоретическому определению кривых придется подождать до лучших времен. Количество уже доступной теоретической информации послужит средствами проверки правомочности каждого набора эмпирических результатов и позволит разумную экстраполяцию кривых выше современных пределов техники шоковой волны. Таблица 20 – это сравнение теоретических объемов, основанных на эмпирическом объеме для каждого сегмента кривых, как и в предыдущих таблицах, с результатами шоковой волны, полученных в Лос Аламосе5 для элементов, которые исследовались при применении самой широкой области давлений. За исключением увеличения коэффициентов сжатия поблизости от 100.000 кг/см2, кривые сжатия, установленные на основе измерений Бриджмена, расширяются на более низкую область экспериментов шоковых волн. В этих случаях теоретические объемы вплоть до первого изменения коэффициентов сжатия вычислены на основе нулевого объема, выбранного из данных Бриджмена. В этой таблице не определяется никакая нулевая точка. Таблица 20: Сжатия шоковой волны
Удивительная характеристика сравнений такова, что согласование между результатами шоковой волны и теоретическими объемами настолько же близкое, как и согласование между статическими объемами Бриджмена и теорией. Верно, что для сравнения сознательно выбран этот набор измерений, и он представляет скорее самые лучшие результаты, чем средние. Но в любом событии тесная корреляция является значимым подтверждением правомочности и техник шоковой волны, и теоретических отношений. Сейчас возникает вопрос: Какому курсу следует сжимаемость выше области давления этой таблицы. В некоторых случаях представляется возможным переход к меньшему базовому объему. Например, при определенном давлении, выше, чем в этой таблице, медь может сдвигаться к вращениям предшествующих электроположительных элементов. Кроме таких особых случаев, коэффициенты, определяющие сжимаемость в области ниже двух миллионов атмосфер, достигли этих пределов. Однако на нынешней стадии исследования нельзя исключить вероятность того, что при крайних давлениях в картину может вноситься какой-то новый фактор. “Коллапс” атомной структуры типа, предвиденного ядерной теорией, конечно, невозможен. Но сейчас дела обстоят так, что мы не в том положении, чтобы говорить, что исследованы все аспекты ситуации сжимаемости. Вполне возможно существование доныне неизвестной способности в изменениях атомных движений, которая увеличивала бы сопротивление давлению выше того, что сейчас представляется пределом. Некоторые измерения шоковой волны производились на еще более высоких уровнях давления; и это должно проливать на вопрос какой-то свет. Однако, к сожалению, результаты довольно сомнительны. Три элемента, включенные в эксперименты, свинец, олово и висмут, следуют прямой линии, установленной в таблице 20 вплоть до максимальных давлений около четырех миллионов атмосфер. С другой стороны, пять элементов, измерения которых выполнялись на максимумах между тремя и пятью миллионами атмосфер, демонстрируют значительно меньшие сжатия, чем указывали бы проекции кривых Таблицы 20. Например, расхождение в случае золота составляет почти 8%. Но такие же большие различия имеются и между результатами разных экспериментов, особенно в случае железа. Следовательно, вопрос о том, входит или нет какой-то новый фактор в ситуацию сжатия под давлениями, выше давлений таблицы 20, остается открытым.
5
McQueen and Marsh, Journal of Applied Physics, July 1960.
Глава 3. Расстояния в соединениях Глава 3: Расстояния в соединениях До сих пор, в обсуждении межатомных расстояний, мы имели дело с совокупностями, состоящими из одинаковых атомов. Те же общие принципы применяются и к совокупностям разных атомов, но существование различий между компонентами таких систем вносит новые факторы, которые нам захочется исследовать. Вопросы, рассматриваемые в этой главе, не имеют отношения к комбинациям электроположительных элементов (совокупностям, являющимся скорее смесями или сплавами, чем химическими соединениями). Как отмечалось в главе 18 тома 1, пропорции, в которых такие элементы могут комбинироваться, определяются или ограничиваются геометрическими соображениями, но, если исключить такие влияния, разные атомы могут комбинироваться на той же основе, что и одинаковые. Здесь, по характеру и действию, силы идентичны виду комбинации, которую мы назвали положительной ориентацией. Согласно уже установленным принципам, результирующее электрическое вращение равно (t1t2)1/2, геометрическому среднему двух составляющих. Если два элемента обладают разными магнитными вращениями, результирующее тоже будет геометрическим средним индивидуальных вращений, поскольку магнитные вращения всегда обладают положительными смещениями и комбинируются так же, как положительные электрические смещения. Следовательно, выведенные действующие электрические и магнитные удельные смещения можно ввести в надлежащие уравнения силы и расстояния из главы 1. Комбинации разных положительных атомов могут иметь место и на основе обратной ориентации, альтернативной структуры, доступной совокупности элементов. Если электрические вращения компонентов разные, результирующее удельное вращение двухатомной комбинации не будет требуемым нейтральным 5 или 10, а вторая пара атомов, ориентированная противоположно первой, создаст четырехатомную структуру, обладающую необходимым равновесием вращения. Как указывалось в томе 1, самый простой вид комбинации в химических соединениях базируется на нормальной ориентации, в которой электроположительные элементы Деления I соединяются с электроотрицательными элементами Деления IV на основе численно равных смещений. Результирующее действующее удельное магнитное вращение можно вычислить так же, как и для всех положительных структур. Но, как мы видели в обсуждении межатомных расстояний элементов, когда между положительными и отрицательными электрическими вращениями устанавливается равновесие, результирующее является суммой двух отдельных величин, а не средним. Таблица 7: Расстояния – Соединения вида NaCl
Когда такая компоновка объединяет один электроположительный атом с другим электроотрицательным атомом, результирующая структура обычно представляет собой простой куб, с атомами каждого элемента, занимающими противоположные углы куба. Такая структура называется хлоридом натрия – самый знакомый член семейства соединений, кристаллизующихся в такой форме. Таблица 7 предоставляет межатомные расстояния ряда обычных кристаллов вида NaCl. Из нее видно, что определенные характеристики вращения, свойственные элементам, входящим в совокупности, переносятся и на их соединения. Второй элемент в каждой группе показывает то же предпочтение для вращения на основе вибрации два, с каким мы сталкивались при исследовании структур элементов. Здесь, вновь, предпочтение распространяется на некоторые из последующих элементов. И в таких сериях соединений как CaO, SeN, TiC, на протяжении всех серий, один компонент сохраняет статус вибрации два, а результирующие действующие вращения представляют 5½, 7, 8½, а не 6, 8 и 10. Как и в ранее исследованных структурах элементов, в соединениях, элементы самых низких групп обладают измерениями с недействующей силой. Если у обоих компонентов действующие измерения не одинаковы, вся сила вращения более активного компонента действует в его оставшихся измерениях, а действующее вращение в неактивном измерении равно единице. Например, величина ln t для магнитного вращения 3 составляет 1,099 в трех измерениях или 0,7324 в двух измерениях. Если это двумерное вращение комбинируется с трехмерным магнитным вращением x, результирующая величина ln t равняется (0.7324 x)½, геометрическому среднему индивидуальных величин в двух измерениях и x в третьем. Средняя величина для всех трех измерений составляет (0.7324 x2)¹/3. Не активность измерений в более низких группах играет лишь незначительную роль в структурах элементов, что может быть видно из того факта, что ей не уделяется никакого внимания вплоть до почти конца Таблицы 8. Соединения лития с одновалентными, отрицательными элементами следуют обычному паттерну и включены в таблицу 7, но в соединениях с двухвалентными элементами, паттерны не обычные, поэтому они опущены в таблице 8. Как мы увидим в главе 6, необычность возникает за счет того, что два атома лития в молекуле типа CaF2 действуют как радикал, а не как независимые составляющие молекулы. Таблица 8: Расстояния – Соединения вида CaF2
Таблицы 7 и 8, две таблицы для нормальной ориентации, предлагают впечатляющее подтверждение правомочности теоретических находок. Когда имеешь дело с межатомными расстояниями, одной из проблем является: Из-за относительно небольшого общего числа элементов, количество элементов, к которым можно применить любую конкретную магнитную комбинацию вращения, тоже невелико. Отсюда, с первого взгляда, довольно трудно установить аутентичность величин вращения. Но это не относится к соединениям обычного типа, поскольку они более многочисленны и менее переменчивы. В таблицах есть два элемента, сера и хлор, обладающие разными магнитными вращениями при разных условиях. В кристаллах вида CaF2 и в виде комбинаций с элементами Группы 4А они обладают вращением 4-3. В других соединениях вида NaCl они обладают вращениями 3½-3½. Имеются и еще два элемента, каждый из которых, согласно ныне доступной информации, отклоняется от нормальных вращений в одном из перечисленных соединений. Все элементы, входящие в 60 соединений в двух таблицах обладают одинаковыми магнитными вращениями в каждом соединении, в котором они участвуют. Кроме того, когда принимаются во внимание различия между совокупностями элементов и соединениями, между вращениями в соединениях и удельными вращениями тех же элементов в совокупностях элементов имеется согласованность. Самое известное различие такого вида является результатом того, что элемент Деления IV в соединении играет чисто отрицательную роль. По этой причине, он принимает магнитное вращение следующей более высокой группы. В совокупностях элементов, половина атомов переориентируется так, чтобы участвовать в положительной роли. Поэтому, они стремятся сохранять обычное вращение группы, к которой принадлежат на самом деле. Например, элементы Группы 3А Деления IV, германий, мышьяк, селен и бром, обладают обычным удельным вращением их группы, 4-3, в кристаллах элементов, но в соединениях они принимают удельное вращение 4-4 Группы 3В, выступая в качестве отрицательных членов этой группы. Еще одно различие между двумя классами структур в том, что элементы более высоких групп, имеющие выбор расширения вращения на вторую единицу вибрации, меньше делают это, если комбинируются с элементом, вращающимся исключительно на основе вибрации один. Кроме этих отклонений по известным причинам, величины удельного магнитного вращения, определенные для элементов в главе 2, применимы и к соединениям. Такая эквивалентность не применяется к удельным электрическим вращениям. Поскольку они определяются способом, которым вращения составляющих каждой совокупности ориентируются относительно друг друга, в двух классах структур отношение другое. Применение тех же уравнений и, в общем, тех же числовых величин к вычислению расстояний в элементах и соединениях резко контрастирует с традиционной теорией, которая рассматривает межатомное расстояние как определяемое “размерами” атомов. Например, атом или “ион” натрия в кристалле NaCl имеет радиус только 60% радиуса атома в совокупности, состоящей из элементов. Если этот атом участвует в комбинации, которая не включается в класс “ионных”, нынешняя теория предлагает другой “размер” – то, что называется “ковалентным” радиусом. Насколько мы можем сказать, необходимость допущения необычного изменения в размере одного и того же объекта устраняется находкой, что изменения межатомного расстояния не имеют ничего общего с размерами атомов, а просто указывают на различия в положении равновесия между силами, направленными вовне и наружу, действию которых подвергаются атомы. Другой вид ориентации, формирующий относительно простое бинарное соединение, - комбинация вращений, которую мы обнаруживаем в ромбовидной структуре. Как у элементов, это равновесие между атомом элемента Деления IV и атомом элемента Деления III, требование, чтобы t1+ t2 = 8. Очевидно, что этому требованию удовлетворяют только те элементы, чье отрицательное смещение вращения (валентность) равна 4, но любой элемент Деления IV может устанавливать равновесие такого вида с подходящим элементом Деления III. С кубическим ромбовидным классом кристаллов типа сульфида цинка тесно связана шестиугольная структура, основанная на той же ориентации и содержащая те же равные пропорции двух составляющих. Поскольку в двух формах эти контролирующие факторы идентичны, кристаллы класса шестиугольной окиси цинка обладают теми же межатомными расстояниями, что и соответствующие структуры сульфида цинка. В примерах, когда межатомные силы одинаковы, существует небольшое вероятностное преимущество одного вида кристалла над другим, и при подходящих условиях может формироваться любой из этих кристаллов. Таблица 9 демонстрирует межатомные расстояния для некоторых обычных кристаллов этих двух классов. Таблица 9: Расстояния – Соединения ромбовидного типа
Комментарии, высказанные по поводу состоятельности величин удельного вращения в таблицах 7 и 8, относятся и к величинам таблицы 9. Большинство элементов, участвующих в соединениях этой таблицы, имеет те же вращения, что и в предыдущих таблицах, а там, где имеются исключения, отклонения носят обычную и предсказуемую природу. Характерная черта Таблицы 9 – появление одного из обычно электроположительных элементов Группы 2В, алюминия, в роли элемента Деления III. Бериллий и магний тоже формируют соединения типа ZnS, но в отличие от ранее упомянутых соединений лития, они нерегулярны, возможно, по той же самой причине, и не внесены в таблицу. Поведение Деления III у элементов, обычно относящихся к Делению I, - результат маленького размера более низких групп, которое помещает элементы Деления I в те же положения относительно электроотрицательной нулевой точки, что и элементы больших групп Деления III. Эти отношения приведены в следующей таблице, где звездочки определяют те элементы, которые обычно находятся в Делении I.
Ни одна из уже рассмотренных ориентаций не применима к соединениям элементов Деления II. Обычная ориентация не существует выше удельного вращения 5, поскольку более высокая величина помещала бы относительное вращение выше ограничивающей величины 10. Виды соединений окиси цинка и сульфида цинка являются электроотрицательными структурами, и обратная ориентация структур элементов Деления II не применима для соединений с отрицательными элементами. Поэтому, элементы деления II формируют свои соединения на основе магнитной ориентации. Этот вид структуры теоретически доступен для любого элемента, но его использование ограничено соображениями вероятности. Он используется во многих соединениях Делений III и IV, особенно в группах более высокого вращения, но редко появляется в соединениях Деления I, из-за очень высокой вероятности обычной ориентации в этом делении. Поскольку магнитное вращение распределяется на все три измерения, его действующий компонент не меняется при изменении в положении, и обладает той же величиной в магнитных ориентациях, что и в соответствующих соединениях, основанных на электрических ориентациях. Однако, чтобы установить магнитный тип равновесия, ось отрицательного электрического вращения должна быть параллельна оси одного из магнитных вращений, следовательно, она перпендикулярна оси положительного электрического вращения. Следовательно, последнее не принимает участия в обычном равновесии межатомных сил и представляет собой дополнительное влияние ориентации, влияния которого обсуждались в томе 1. В соединениях магнитного типа, смещение отрицательного компонента (-x) уравновешивается численно равным положительным смещением (x). Поэтому, магнитная ориентация в чем-то подобна обычной ориентации. Однако по векторному направлению магнитное вращение противоположно электрическому вращению, и результирующее относительное вращение, действующее в измерении соединения, - это одна из нейтральных величин 10, 5 или комбинация этих двух, а не 2x обычной ориентации. Соединения, основанные на магнитной ориентации, появляются в виде разнообразия кристаллических форм, природа которых зависит от степени симметрии сил и числа атомов каждого вида в системе равновесия. В некоторых случаях, имеется достаточно симметрии для формирования однородных структур вида NaCl, CaF2 и подобных видов. Другие кристаллы асимметричны. Общая компоновка бинарных соединений – это структура арсенида никеля, шестиугольного кристалла, в котором положительные атомы занимают положения на гранях, а отрицательные атомы находятся в центральных положениях, находящихся на расстоянии ¼ или ¾ на оси с. Таблица 10 демонстрирует межатомные расстояния, вычисленные для NiAs и NaCl, вид кристаллов бинарной магнитной ориентации соединений Группы 3А. Таблица 10: Расстояния – соединения бинарной магнитной ориентации
Почти все соединения типа NiAs, которые были исследованы в ходе настоящей работы, принимают величину вибрации один удельного электрического вращения – 10. Соединения магнитной ориентации со структурой NaCl довольно равномерно делятся между вращением 10 и комбинацией 5-10 в Группе 3А, но в более высоких группах почти всегда пользуются вращением 5-10. Чтобы в ограниченном объеме данной работы показать, насколько широко разнообразие характеристик этих соединений магнитного типа, Таблица 10 ограничивается соединениями Группы 3А. А последующая Таблица 11 предлагает данные типичных соединений редкоземельных элементов (из Группы 4А), наряду с выборкой соединений из Группы 4В, в которой выделены идентичные величины межатомного расстояния в комбинациях элементов этой группы с элементами Группы 2А Деления IV. Таким образом, до настоящего момента, вычисление расстояний равновесия выполнялось для кристаллических видов ввиду удобства определения влияния характеристик разных атомов на кристаллическую форму и измерения. Однако ясно, что определение кристаллического типа не всегда существенно для определения межатомного расстояния. Например, давайте рассмотрим серии соединений NaBr, Na2Se, и Na3As. Из отношений, установленных на предыдущих страницах, мы можем прийти к выводу, что соединения Деления I формируются на основе обычной ориентации. Поэтому, мы применяем известную величину относительного электрического удельного вращения обычной ориентации соединения натрия, 4, и известные величины обычного магнитного удельного вращения натрия и элементов Группы 3В, 3-3½ и 4-4 соответственно в уравнении 1-10. И убеждаемся, что наиболее вероятное межатомное расстояние во всех трех соединениях составляет 2,95, независимо от кристаллической структуры. (Измеренные величины составляют соответственно 2,97, 2,95 и 2,94.) Вероятные межатомные расстояния в более сложных соединениях можно вычислить аналогичным образом, без необходимости анализа огромного разнообразия геометрических структур, в которые кристаллизуются эти соединения. На современной стадии теоретического развития, польза данной техники в применении к соединениям вообще ограничена, потому что обычно мы не способны определить удельные вращения из теоретических допущений так же точно, как в предыдущей иллюстрации. Однако эта величина значима, когда мы имеем дело с более низкими электроотрицательными элементами, чьи удельные электрические вращения совпадают с нейтральными величинами, и чье разнообразие в магнитных измерениях проявляется лишь в количестве неактивных измерений (то есть, измерениях, в которых удельное вращение равно 2). Вовлеченные элементы относятся к Группам 1В и 2А – водороду, углероду, азоту, кислороду и флуорену, наряду с бором – одним из обычно электроположительных элементов Группы 2А. Два других положительных элемента этой группы, литий и бериллий, тоже двумерны в большинстве условий, но они принимают положительную ориентацию и обладают намного большими межатомными расстояниями. Таблица 11: Расстояния – Соединения бинарной магнитной ориентации
Таблица 12 предлагает теоретически возможные межатомные расстояния этих элементов более низких групп, с некоторыми примерами измеренных величин, соответствующих вычисленным расстояниям. Таблица 12: Расстояния – Низшие отрицательные элементы
Экспериментальные результаты совсем не согласуются с теорией. Напротив, они широко рассеяны. Например, расстояния С-С охватывают почти всю область от 1,18 – минимума для этой комбинации, до максимума 1,54. Однако, основные соединения каждого класса согласуются с теоретическими величинами. Парафиновые углероды, углеводороды, бензол, этилен и ацетилен имеют расстояния, приближающиеся к теоретическим, - 1,54, 1,41 и 1,30 соответственно. Все расстояния СН близки к теоретическим 0,92 и 1,06, и так далее. Следовательно, разумно прийти к выводу, что значительные отклонения от теоретических величин происходят за счет особых факторов, которые применяются к менее правильным структурам. Детальное исследование причин подобных отклонений выходит за рамки настоящей работы. Однако имеются две довольно очевидные причины, заслуживающие упоминания. Первая причина: Силы, оказываемые соседним атомом, могут изменять обычный результат взаимодействия двух атомов. В этой связи, интересно, что оказываемое действие обратное; то есть, увеличивающееся разделение атомов, а не уменьшение разделения, как следовало бы ожидать. Естественная система отсчета всегда движется с единицей скорости, независимо от положений структур, к которым она применяется. Соответственно, сила, направленная вовнутрь за счет этой последовательности, всегда остается одной и той же. Любое взаимодействие с третьим атомом вносит дополнительную силу движения наружу, и, следовательно, сдвигает точку равновесия наружу. Это демонстрируется в измеренных расстояниях у многоатомных производных бензола. Наименьшие расстояния С-С в этих соединениях 1,38 и 1,39 обнаруживаются на внешних концах молекулярных структур, в то время как соответствующие расстояния внутри соединений, где влияние соседних атомов максимально, характерная область от 1,41 до 1,43. Еще одна причина расхождений: Во многих примерах, измерение и теоретическое вычисление не относятся к одному и тому же количеству. Вычисление дает расстояние между структурными единицами, а измерения относятся к расстоянию между определенными атомами. Если атомы являются структурными единицами, как в соединениях класса NaCl, или если расстояние между группами совпадает с межатомным расстоянием, как у обычных парафинов, проблемы нет. В противном случае, не следует ожидать точного согласования. И вновь, в качестве примера мы можем воспользоваться бензолом. Сообщается, что у бензола расстояние С-С равно 1,39, в то время как соответствующее теоретическое расстояние, как указано в Таблице 12, составляет 1,41. Но, согласно теории, бензол не является кольцом атомов углерода с примыкающими атомами водорода, это кольцо нейтральных групп СН. Поэтому, расстояние между этими нейтральными группами, структурными единицами атома обладает нейтральной величиной 1,41. Поскольку известно, что атомы водорода находятся вне атомов углерода, если это атомы копланарны, из этого следует, что расстояние между действующими центрами групп СН должно быть больше, чем расстояние между атомами углерода этих групп. Следовательно, измерение 1,39 между атомами углерода полностью согласуется с теоретическими вычислениями расстояния. Тот же вид отклонения от результатов непосредственного взаимодействия между двумя отдельными атомами происходит в крупном масштабе, если имеется группа атомов, действующих структурно как радикал. Многие свойства молекул, частично или полностью состоящих из радикалов или нейтральных групп, определяются не характеристиками атомов, а характеристиками групп. Например, радикал NH4 обладает теми же удельными вращениями, действуя, как группа, что и атом рубидия, и в кристаллах типа NaCl галида рубидия может быть заменен без изменения объема. Поэтому, в соединениях, содержащих такие группы, межатомное расстояние не имеет непосредственного значения. Теоретически можно определить местонахождение действующих центров разных групп и измерить межатомные расстояния, соответствующие вычисленным теоретически, но такая попытка еще не предпринималась. Поэтому сейчас невозможно представить сравнение между теоретическими и экспериментальными расстояниями в соединениях, содержащих радикалы, для сравнения с Таблицами 1-12. Однако получены некоторые предварительные результаты об отношении между теоретическими расстояниями и плотностью в сложных соединениях. Имеется ряд факторов, еще не исследованных детально, оказывающих какое-то влияние на плотность твердой материи. По этой причине, выводы, сделанные из теории, экспериментальны, а корреляция между теорией и наблюдением лишь приблизительна. Тем не менее, некоторые аспекты экспериментальных результатов значимы и достаточно интересны, чтобы оправдать уделенное им внимание. Если мы разделим молекулярную массу, в терминах единиц атомного веса, на плотность, мы получим молекулярный объем в терминах единиц, входящих в измерение плотности. Для нынешних целей, будет удобно превратить эту величину в естественные единицы объема. Коэффициент превращения – это куб единицы расстояния региона времени, деленный на единицу массы атомного веса. В системе единиц СГС, числовая величина составляет 14,908. Таблица 13: Молекулярный объем
В Таблице 13 средние объемы на объемную группу числа неорганических соединений, содержащие радикалы (V), вычисленные из измеряемых плотностей, сравниваются с кубами межгрупповых расстояний (S03), вычисленных на предварительно описанной теоретической основе. Удельное электрическое вращение (с) соединений с обычной ориентацией равно 4, как у одновалентных бинарных соединений. Соединения с магнитной ориентацией принимают нейтральную величину 5. Удельные магнитные вращения для положительного компонента и отрицательного радикала показаны в колонках, озаглавленных соответственно ab1 и ab2. Колонки 2, 3 и 4 показывают молекулярную массу (m), плотность твердого соединения (d) и число объемных единиц в молекуле (n). Как и в предыдущих таблицах, вычисленные и эмпирические величины не одинаковы, поскольку использовались непосредственные величины плотностей, а не спроецированные до нулевой температуры. Для точности потребовалась бы обработка, но она не оправдана на ранней стадии исследования. В таблице имеются пять пар соединений, таких как Ca(NO3)2 и KNO3, в которых межгрупповые расстояния одинаковы. Единственная разница между парами, если рассматриваются факторы объема, в количестве структурных групп. Из-за неясностей, связанных с измеренными плотностями, трудно прийти к выводам на основе каждой пары, рассмотренной индивидуально, но вычисленный из плотности средний объем на группу в пяти двухгрупповых структурах составляет 1,267, в то время как в пяти трехгрупповых структурах средняя величина составляет 1,261. Отсюда очевидно, что объемное качество группы и независимого атома, которое мы отмечали в случае радикала NH4, является общим суждением, по крайней мере, в этом классе соединений. Данное положение будет иметь особое значение, когда мы предпримем рассмотрение отношений объемов жидкости. Завершая обсуждение в этой главе, уместно повторить, что величины межатомного и межгруппового расстояния, выведенные из теории, относятся к данным, которые существовали, если бы равновесие достигалось при нулевой температуре и нулевом давлении. В следующих двух главах, мы будем обсуждать, как меняются эти расстояния, если твердая структура подвергается конечным давлениям и температурам. Глава 2. Межатомные расстояния Глава 2: Межатомные расстояния Уравнение 1 – 10 указывает, что расстояние между любыми двумя атомами в твердой совокупности – функция определенных вращений атомов. Поскольку каждый атом способен принимать любое из нескольких разных относительных ориентаций вращательных движений, из этого следует, что для каждой комбинации атомов имеется ряд определенных возможных вращений. Число возможных альтернатив увеличивается за счет двух дополнительных факторов, которые уже обсуждались. Как отмечалось в главе 10 тома 1, атом обладает вариантом вращения с обычным магнитным смещением и положительным электрическим смещением или со следующим более высоким магнитным смещением и отрицательным электрическим приращением. В любом случае, действующую величину, удельное вращение, можно изменить расширением движения на вторую единицу вибрации, как говорилось в главе 1. При надлежащих условиях, можно реально осознавать каждый из многих вариантов величины удельного вращения и соответствующие величины межатомных расстояний. Но в любом конкретном наборе обстоятельств, одни комбинации вращений более вероятны, чем другие. В обычной практике число разных величин расстояния между одними и теми же двумя атомами относительно невелико, кроме каких-то особых случаев. Сейчас дела обстоят так, что из теоретических допущений мы можем вычислить небольшой набор вероятных межатомных расстояний для каждого элемента и соединения. Бесспорно, было бы желательно детально оценить вероятные отношения так, чтобы результаты вычислений были как можно более индивидуальными, но предпринимать полное исследование вероятности отношений в этой работе было бы не осуществимо. В исследовании такой обширной области как структура физической вселенной, приходится не только отбирать раскрываемые темы, но и решать, до какой степени они будут освещаться. Возможно полезно скрупулезное рассмотрение отношений вероятности, входящих в физические ситуации, но время и усилие, требующиеся для выполнения этого проекта, бесспорно, будут огромными, а вклад в основные цели этого труда недостаточным, чтобы оправдать размещение таких больших ресурсов. Решения, насколько далеко должно заходить исследование в конкретных областях, должны приниматься время от времени по ходу работы, чтобы ограничить ее конечный объем. В этой связи, хорошо бы указать, что вычисление уникального межатомного расстояния для каждого элемента или комбинации элементов никогда не будет возможно, даже когда будут четко установлены отношения вероятности, поскольку во многих случаях выбор из возможных альтернатив – это не только вопрос относительной вероятности, но и истории конкретного образца. Если в области физических условий, при которых выполняется эмпирическое исследование, устойчивы две или больше альтернативные формы, обработка, которой уже подвергался образец, играет важную роль в определении структуры. Однако из этого не следует, что мы полностью препятствуем получению определенных величин межатомных расстояний. Хотя еще не существует количественной оценки относительных вероятностей, природа главных факторов, включенных в их определение, может быть выведена теоретически. В большинстве случаев, качественной информации достаточно, чтобы исключить все, кроме нескольких величин возможных вариаций конкретных вращений. Кроме того, имеется ряд отношений, посредством которых область изменчивости может быть сужена еще больше. Эти паттерны станут очевидными, когда в следующей главе мы будем исследовать расстояния в соединениях; они будут рассматриваться более детально. Поскольку мы начинаем анализ факторов, определяющих межатомное расстояние, первое, что следует подчеркнуть, - мы имеем дело не с размерами атомов, мы оцениваем расстояние между положениями равновесия, которые занимают атомы при конкретных условиях. В главе 1 мы исследовали общую природу атомного равновесия. В этой и следующей главе мы увидим, как разные факторы, включенные в отношения между вращениями взаимодействующих атомов, влияют на точку равновесия; мы придем к величинам межатомных расстояний при статических условиях. Затем, в главах 5 и 6, мы будем развивать количественные отношения, которые позволят определить, какие изменения происходят в расстояниях равновесия, когда вмешиваются внешние силы в виде давления и температуры. Как мы видели в предыдущем томе, все атомы и совокупности материи подвергаются действию двух противоположных сил общей природы: гравитации и последовательности естественной системы отсчета. Это и есть те первичные силы (или движения), которые определяют ход физических событий. Вне гравитационных пределов самых больших совокупностей, движение наружу за счет последовательности естественной системы отсчета превышает движение вовнутрь под действием гравитации. Такие совокупности, главные галактики, удаляются друг от друга со скоростями, увеличивающимися с расстоянием. Внутри гравитационных пределов, гравитационное движение больше, и все атомы и молекулы движутся вовнутрь. В конечном счете, если ничего не вмешивается, движение вовнутрь несет каждый атом в пределах единицы расстояния другого атома, и перевороты направления, совершающиеся на границе единицы, приводят к установлению равновесия между движениями двух атомов. Межатомное расстояние – это расстояние между центрами атомов в состоянии равновесия. Это не определение размеров атомов, как считают сейчас. Современная теория, рассматривающая межатомное расстояние как измерение “размера”, во многих отношениях схожа с теорией электронной “связи” молекулярной структуры. Подобно электронной теории, она базируется на ошибочном допущении. В данном случае, это допущение, что в твердом состоянии атомы пребывают в контакте. Как и электронная теория, она годится лишь для относительно небольшого числа веществ в их простой форме. Поэтому для объяснения отклонений наблюдаемых расстояний от тех, какими им положено быть, приходится прибегать к изобилию дополнительных и вспомогательных гипотез. Как говорится в учебниках, даже в металлах, которые с точки зрения теории являются самыми простыми структурами, имеется много трудных проблем, включая тот факт, что допускаемый “размер” меняется в зависимости от кристаллической структуры. Некоторые дальнейшие аспекты этой ситуации будут рассматриваться в главе 3. Сходство между этими двумя ошибочными теориями не связано с отсутствием адекватных основ и природой трудностей, с которыми они сталкиваются. Оно расширяется до решения этих трудностей, в то время как те же принципы, выведенные из постулатов Обратной Системы для рассмотрения образования молекул химических соединений, будучи приложены другим способом, являются общими рассуждениями, управляющими величиной внутриатомного расстояния в элементах и соединениях. Бесспорно, все совокупности электроотрицательных элементов обладают скорее молекулярным составом, чем атомным, поскольку молекулярное требование - отрицательное электрическое смещение атома такого элемента должно уравновешиваться эквивалентным, положительным смещением для достижения устойчивого равновесия в пространстве - должно применяться и к комбинации с подобным атомом. Как мы видели при исследовании структурной ситуации, электроположительные элементы не подвергаются такому ограничению, но во многих случаях, молекулярный (со сбалансированной ориентацией) вид структуры превалирует над электроположительной структурой по причине сопутствующих факторов, влияющих на относительную вероятность. Вследствие того факта, что расстояния следуют структурному паттерну, разные способы ориентирования атомных вращений, которые обсуждались в главе 18 тома 1, с небольшими модификациями за счет конкретных условий, существующих в совокупностях элементов, определяют способ, как атомы элемента могут комбинироваться друг с другом и действующие величины конкретных вращений в этих комбинациях. На первый взгляд, конкретные вращения электроположительных элементов основываются на смещениях вращения, описанных в главе 10 тома 1. Там где межатомная ориентация представляет собой обычную положительную компоновку, смещения напрямую переводятся в конкретные вращения путем прибавления первичной единицы, и уменьшения величин приращения там, где вращение распространяется на вибрацию два. За исключением элементов группы 2А, которые, как уже отмечалось, являются предметом особых соображений из-за их низких магнитных смещений, все элементы Деления I следуют регулярному электроположительному паттерну конкретных вращений. Единственные нарушения - электрические вращения вторых и третьих элементов каждой группы, где точка перехода к вибрации два меняется между группами. Внутриатомные расстояния в этом делении приводятся в таблице 2. Регулярный электроположительный паттерн относится и к Делению II, и ряд элементов группы 3А Деления II кристаллизуется на этой основе, с межатомными расстояниями, определяемыми так же, как и для Деления I. Однако, как отмечалось в томе 1, элементы Деления II обычно благоприятствуют магнитному типу ориентации в химических соединениях, потому что при увеличении смещения, обычная положительная ориентация становится менее вероятной. Те же соображения вероятности работают против положительной ориентации в элементах этого деления, но вместо использования в качестве альтернативы магнитной ориентации, эти элементы пользуются видом ориентации, доступным лишь тогда, когда все вращения каждого участника соединения идентичны друг другу. Такая компоновка переворачивает действующие направления вращений альтернативных атомов. Итоговое относительное вращение является комбинацией x и 8-x (или 4-x), как при нейтральной ориентации, а действующие конкретные вращения: 10 для вибрации один и 5 для вибрации два. Также обычна величина комбинации 5-10. Таблица 2: Расстояния - Деление I
Обратный вид структуры появляется в объемно-центрированных кубических кристаллических формах хрома и железа, которые сосуществуют с регулярными положительными шестиугольными или гранецентрированными структурами. Первые элементы соответствующих групп Деления II, ванадий и ниобий, сочетают положительные и обратные ориентации. Выше ниобия, в общих формах элементов Деления II, положительная ориентация не появляется, по крайней мере, в тех структурах, которыми ограничивается нынешнее обсуждение. И все элементы принимают обратную ориентацию, кроме европия и иттербия, которые сочетают обратную ориентацию с одним определенным вращением; то есть, полностью отсутствует электрическое смещение вращения, как у элементов инертного газа. На основании соображений, обсужденных в главе 1, среднее действующее конкретное вращение для таких комбинаций вращения принимается как геометрическое среднее двух компонентов. Если ориентации одинаковы и отличаются только по величине, как в комбинации 5-10, и в комбинациях магнитных вращений, с которыми мы столкнемся позже, равновесие достигается обычным способом. Если включаются два разных электрических вращения, двухатомная пара не может достичь пространственного равновесия индивидуально, но они создают групповое равновесие, аналогичное тому, которое достигается, когда n одновалентных атомов каждый комбинируются внутри одного атома валентности n. Расстояния Деления II показаны в Таблице 3. Таблица 3: Расстояния - Деление II
Из-за большей вероятности комбинаций электроположительных видов, характеристики Деления II переносятся на первые элементы Деления III, и эти элементы, никель, палладий и лютеций, включены в таблицу. Некоторые подобные модификации обычных границ деления уже отмечались в связи с другими темами. Общее итоговое вращение материального атома – это вращение с положительным смещением; то есть, со скоростью меньше единицы. Как таковое, такое смещение обычно приводит к изменению положения в пространстве. Однако внутри единицы пространства, все движение является движением во времени. Следовательно, ориентация атома с целью пространственно-временного равновесия существует в трех измерениях времени. Как мы видели в исследовании межрегиональной ситуации в главе 12 тома 1, каждое из измерений индивидуально контактирует с пространством региона вне единицы расстояния. В той степени, в которой движение в измерении времени действует вдоль линии контакта, оно является движением в эквивалентном пространстве. В противном случае, оно не обладает пространственным действием выше границы единицы. Из-за независимости трех измерений движения во времени, относительная ориентация электрического вращения любой комбинации атомов может быть одинаковой со всеми измерениями пространства или могут быть две или три разных ориентации. У большинства уже обсужденных элементов, ориентация одинакова во всех измерениях пространства, а в исключениях альтернативные вращения симметрично распределяются в твердой структуре. Система сил совокупности таких элементов однородна. Из этого следует, что любая совокупность атомов этих элементов обладает структурой, в которой составляющие организованы в одном из геометрических паттернов, возможных для равных сил: равновеликий кристалл. Все электроположительные элементы (Деления I и II) кристаллизуются в равновеликих формах, и за исключением некоторых, обладающих более сложными структурами, каждая кристаллическая форма этих элементов принадлежит одному или другому их трех типов: объемно-центрированной, кубической гранецентрированной или шестиугольной плотноупакованной структуры. Сейчас мы переходим к другому главному подразделению элементов, электроотрицательному классу, элементам, чье нормальное электрическое смещение отрицательное. Здесь, система сил не обязательно однородна, поскольку самая вероятная компоновка в одном или двух измерениях может быть отрицательной ориентацией, прямой комбинацией двух отрицательных электрических смещений, аналогичной обще-положительным комбинациям. Нельзя иметь отрицательную ориентацию во всех трех измерениях. И если она существует в одном или двух измерениях, силы вращения атомов обязательно неоднородны. Контролирующий фактор – требование, чтобы общее итоговое смещение вращения материального атома как целого было положительным. Очевидно, что отрицательная ориентация во всех трех измерениях несовместима с этим требованием. Но если отрицательное смещение ограничивается одним измерением, совокупность обладает фиксированными атомными положениями в двух измерениях, с фиксированным средним положением в третьем измерении из-за положительного смещения атома в целом. Это приводит к кристаллической структуре, которая, по сути, эквивалентна одному из фиксированных положений во всех измерениях. Обычно, такие кристаллы не изомерны, поскольку межатомное расстояние в четном измерении обычно отличается от межатомного расстояния двух других. Если случится так, что расстояния во всех измерениях совпадают, в последующем обсуждении мы обнаружим, что симметрия пространства не является указателем на симметрию сил. Если отрицательное смещение совсем невелико, как у нижних элементов Деления IV, отрицательную ориентацию в двух измерениях можно иметь, если положительное смещение в третьем измерении превышает сумму двух отрицательных компонентов так, что итоговый результат все еще положительный. Здесь, относительные положения атомов фиксируются лишь в одном измерении, но средние положения в двух других измерениях постоянны по причине итогового, положительного смещения атомов. Совокупность таких атомов сохраняет большинство внешних характеристик кристалла, но при исследовании внутренней структуры, представляется, что атомы распределяются скорее случайно, чем в обычной упорядоченной компоновке кристалла. На самом деле, здесь имеется столько же порядка, сколько и в кристаллической структуре, но часть порядка пребывает скорее во времени, чем в пространстве. Такая форма материи определяется как стекловидная или стеклообразная форма, в отличие от кристаллической формы. В этой связи, термин “состояние” часто употребляется вместо “формы”, но физическое состояние материи обладает и другим значением, основанном на других критериях. Поэтому, представляется целесообразным свести использование этого термина к одному применению. И стекла, и кристаллы пребывают в твердом состоянии. Приступая к рассмотрению структур отдельных электроотрицательных элементов, мы будем начинать с Деления III. Общая ситуация в этом делении аналогична ситуации в Делении II, но отрицательность обычного электрического смещения вносит новый фактор в определение паттерна ориентации, поскольку самая вероятная ориентация электроотрицательного элемента может не существовать во всех трех измерениях. Как констатировалось раньше, если в данном наборе обстоятельств возможны две или более разных ориентаций, решающим фактором является относительная вероятность. Низкие смещения более вероятны, чем высокие. Простые ориентации более вероятны, чем комбинации. Положительная электрическая ориентация более вероятна, чем отрицательная. В Делении I, все эти факторы работают в одинаковом направлении. Положительная ориентация проста и обладает наименьшей величиной смещения. Следовательно, все структуры этого деления формируются на основе положительной ориентации. В Делении II, поле вероятности уже. Здесь, положительное смещение x больше, чем обратное смещение 8-x, и это работает против большей неотъемлемой вероятности простой положительной структуры. В результате, в этом делении обнаруживаются и положительные и отрицательные виды структур, наряду с комбинацией обоих. В Делении III, отрицательная ориентация обладает статусом, похожим на статус положительной ориентации в делении II. Как простая ориентация, она обладает относительно большей вероятностью. Но она ограничена одним измерением. Следовательно, структуры Групп 3А и 3В Деления III неоднородны, с обратной ориентацией в двух других измерениях. Возможно сочетание двух видов ориентации. У меди и серебра, первых элементов соответствующих групп Деления III, кристаллы формируются на основе комбинированной ориентации, обладающей кубической симметрией. Как и в Делении II, элементы Групп 4А и 4В Деления III, кристаллизуются полностью на основе обратной ориентации. Таблица 4 приводит то, что может рассматриваться как правильные межатомные расстояния элементов Деления III. Таблица 4: Расстояния - Деление III
Хотя в Делении IV вероятность отрицательной ориентации больше, чем в Делении III, за счет меньших величин смещения, этот вид структуры редко появляется в кристаллах низкого деления. Причина в следующем: Если у элементов с низким смещением существует такая ориентация, она существует в двух измерениях, и создает скорее стекловидную или стеклообразную совокупность, чем кристалл. Обратная ориентация не подвергается никакому ограничивающему фактору такой природы, но она менее вероятна при низких смещениях. За исключением группы 4А, где она продолжает доминировать, такая ориентация менее часта по мере уменьшения смещения. Там же, где она существует, она все больше и больше комбинируется с другим видом ориентации. В результате этих ограничений, применимых к более вероятным видам ориентации, многие структуры деления IV формируются на основе вторичной, положительной ориентации, комбинации двух смещений 8 - x. В электроположительных делениях, вторичная, положительная ориентация не возможна, поскольку в этих делениях 8 - x отрицательная, и подобно самой отрицательной ориентации, отрицательная комбинация 8 - x должна принимать подчиненную роль в одном или двух измерениях асимметричной структуры. Такая кристаллическая структура не может соперничать с высокой вероятностью симметричных электроположительных кристаллов и, следовательно, не существует. Однако в электроотрицательных делениях, смещение 8 – x положительное, и здесь нет ограничений, кроме тех, которые возникают за счет высоких величин смещения. Действующее смещение вторичной, положительной ориентации даже больше, чем можно было бы ожидать от величины количества 8 – x, поскольку изменение нулевых точек для двух противоположно направленных движений тоже направлено противоположно, и новые нулевые точки находятся на расстоянии 16–ти единиц смещения друг от друга. Итоговое результирующее смещение равно 16 – 2x, и соответствующее удельное вращение 18 – 2x. В Делении IV, числовые величины последнего выражения лежат в области от 10 до 16. За счет низкой вероятности таких высоких вращений, вторичная, положительная ориентация ограничена одним или половиной измерения, несмотря на ее положительный характер. В Делении III, смещения 8 – x ниже, но в этом случае они слишком низкие. Двух единичное разделение нулевых точек (16 единиц смещения) не может поддерживаться до тех пор, пока действующее смещение не станет равно, по крайней мере, 8-ми (одной полной трехмерной единице). Поэтому, вторичная, положительная ориентация ограничена делением IV. Особый вид структуры возможен лишь у тех элементов, которые обладают смещением вращения в четыре единицы в электрическом измерении. Эти элементы находятся на границе между Делениями III и IV, где одинаково вероятны вторичные, положительные и обратные ориентации. При таких условиях, другие элементы кристаллизуются в шестиугольные или четырехугольные структуры, использующие разные ориентации в разных измерениях. Однако у 4-х элементов с такими смещениями, две ориентации создают одинаковое удельное вращение: 10. Следовательно, межатомное расстояние в этих кристаллах одинаково во всех измерениях, и кристаллы однородны, хотя силы вращения в разных измерениях не носят одинакового характера. Молекулярная компоновка в этом кристаллическом паттерне, ромбовидная структура, демонстрирует истинную природу сил вращения. Внешне этот кристалл нельзя отличить от однородных кубических кристаллов, но аналогичная объемноцентрированная структура имеет атом в каждом углу куба и один в центре куба, в то время как ромбовидная структура оставляет противолежащие углы открытыми для приспособления к необычной проекции сил во вторичном, положительном измерении. У низких элементов Деления IV, пребывающиих выше области обратного вида ориентации, нет доступной альтернативы для комбинации с вторичной, положительной ориентацией. Поэтому, кристаллы этих элементов не обладают действующим электрическим вращением в оставшихся измерениях. Относительное удельное вращение в этих измерениях равно единице, как и у всех элементов инертного газа. Наиболее общие расстояния у совокупностей элементов Деления IV показаны в Таблице 5. Таблица 5: Расстояния - Деление IV
Вплоть до этого момента, не уделялось никакого внимания элементам с атомным номером ниже 10, поскольку силы вращения этих элементов подвергаются определенным конкретным влияниям, что делает желательным их отдельное обсуждение. Одна причина отклонения от нормального поведения – маленький размер вращающихся групп. В больших группах различаются четыре измерения, и за исключением некоторых перекрываний, каждое измерение обладает своими характерными комбинациями сил, что мы видели в предыдущих параграфах. Однако в группе из 8-ми элементов, вторые серии четырех элементов, которые обычно составляли бы деление III, на самом деле находятся в положении Деления IV. В результате, до некоторой степени, эти четыре элемента обладают свойствами обоих делений. Аналогично, элементы этих групп Деления I могут работать, как будто бы они являются членами Деления III. Вторичное влияние, действующее на силы и кристаллические структуры элементов низких групп, - бездействие сил вращения в конкретных измерениях, упомянутых раньше. Удельное вращение двух единиц не действует в положительном направлении. Причина этого раскрывается в уравнении 1 – 1. Применяя это уравнение, мы находим, что действующая сила вращения (ln t) для t = 2 составляет 0,693, что меньше, чем противоположная пространственно-временная сила, равная 1. Следовательно, итоговая действующая сила удельного вращения, равная 2, ниже минимальной величины для действия в положительном направлении. Чтобы создавать действующую силу, удельное вращение должно быть достаточно высоким, чтобы сделать ln t больше единицы. Это достигается во вращении 3. Удельное магнитное вращение группы 1В, включающее лишь два элемента, водород и гелий, и 8 элементов группы 2А, начиная с лития, сочетает величины 3 и 2. Если величина 2 применяется к вспомогательному вращению (3-2), одно измерение не активно; если она применяется к основному вращению (2-3), не активны два измерения. Это уменьшает силу, оказываемую каждым атомом, до 2/3 нормальной величины в случае одного неактивного измерения и до 1/3 для двух не активных измерений. Межатомное расстояние пропорционально квадратному корню произведения двух вовлеченных сил. Следовательно, уменьшение в расстоянии тоже равно 1/3 на каждое не активное измерение. Поскольку электрическое вращение не является базовым движением, а обратным вращением магнитно-вращающейся системы, ограничения, которым подвергается базовое вращение, не работают. Электрическое вращение просто изменяет магнитное вращение, и низкая величина силы, свойственная удельному вращению 2, проявляется как межатомное расстояние, большее чем то, которое превалировало бы, если бы электрического смещения вообще не было (единицы удельного вращения). Теоретические величины межатомных расстояний элементов низких групп сравниваются с измеренными величинами в Таблице 6. Цифры в скобках в колонке 4 этой таблицы указывают на действующее число измерений. Таким образом, обозначение 3(1), показанное для водорода, означает, что этот элемент обладает удельным магнитным вращением 3, действующим лишь в одном измерении. За исключением того, когда кристаллы равновелики, в связи с измерениями расстояния элементов нижних групп имеется много неопределенности. Зафиксированные многие другие дополнительные величины тоже включены в таблицу. Эта ситуация будет подробнее обсуждаться в главе 3, где мы воспользуемся измерениями расстояний между похожими атомами, которые являются составляющими химических соединений. Таблица 6: Расстояния – Элементы нижней группы
Как указывалось во вводных параграфах этой главы, мы еще не в том положении, когда можем определять, каким будет межатомное расстояние для любого данного элемента при данном наборе условий. Обсужденные теоретические соображения во многих случаях реально дают конкретные величины, но в других примерах имеется неопределенность, поскольку наблюдаемой структуре соответствуют две или больше теоретически возможных компоновок смещения. И в теоретической, и в экспериментальной области происходит непрерывный прогресс, и можно ожидать, что неопределенности постепенно сведутся к минимуму, упомянутому раньше. В ходе процесса, обязательно произойдут изменения в отождествлениях наблюдаемых расстояний с теоретически возможными структурами. Сравнение таблиц 1-6 с соответствующими таблицами первого издания было бы интересно как указание на природу и величину изменений, которые произошли в нашей точке зрения на ситуацию с межатомным расстоянием за последние двадцать лет, и, посредством расширения, как указание на объем изменения, которое можно ожидать в будущем. Такое сравнение показывает, что модификации начальных выводов, которые требуются сейчас, в свете доступной дополнительной информации, почти полностью совпадают с теми, которые возникли в результате лучшего теоретического понимания поведения удельных магнитных вращений выше действующей величины 4. Несколько изменений требуется либо в магнитных, либо в электрических величинах в тех комбинациях вращения, в которых удельное магнитное вращение равно 4-4 или меньше. Одной из сбивающих с толку ситуаций вращения, как это представлялось во время первой публикации, была кажущаяся обратной последовательность удельного магнитного вращения в Группах 4А и 4В. В то время считалось, что величины 4½ и 5 удельного вращения соответствуют одинаковому смещению 4, с той лишь разницей, что в случае величины 4½ вращение распространяется на две единицы вибрации, а последнее приращение удельного вращения в этом случае равно только половине размера. Следующее приращение на половину единицы, если бы оно было возможно, привело бы вращение 4½ назад, к величине 5. Таким образом, представлялось, что последовательность удельных вращений выше 4½-4 была бы 4½-4½, 5-4½, 5-5, и так далее. Но тенденция идет в противоположном направлении. По мере увеличения атомного номера, вместо движения к более высоким величинам происходит движение к меньшим величинам. Это было очевидно уже во время публикации первого издания, поскольку меньшие межатомные расстояния ряда элементов от вольфрама до платины не могли приниматься в расчет до тех пор, пока магнитное удельное вращение не падало назад к 4-4½ с более высоких уровней предшествующих элементов Группы 4А. Тенденция уменьшения оказалась еще важнее, когда стали доступны расстояния для дополнительных элементов Группы 4В, поскольку некоторые из величин указывали на удельные магнитные вращения 4–4 или даже 4-3½. Случилось так, что продолжение тенденции к низким величинам в более поздних данных повлияло на прояснение ситуации. Сейчас очевидно, что в доступной части Групп 4А и 4В удельное вращение 5–5 не достигается. (Рассмотрения, которые будут обсуждаться позже, показывают, что удельное вращение 5-5 было бы нестабильным.) Низкие величины в Группах 4А и 4В возникают не в результате уменьшения магнитного смещения, а за счет сдвига существующих единиц смещения с вибрации один к вибрации два, процесс, который наполовину уменьшает удельное вращение единиц. На основе вибрации один, смещения вращения 4-3 соответствует удельным вращениям 5-4. Переход последующих единиц смещения к вибрации два, без изменения числа единиц смещения, выливается в ряды удельных вращений 5-4, 4½-4, 4-4½, 4-4, и так далее. Подобные серии с одной дополнительной единицей смещения проходят через величины 5-4½, 4½-5, 4½-4½, 4½-4, и так далее, а затем следуют тому же пути, что и серии с более низким смещением. Модификации, сделанные в теоретических величинах вращения, относятся к элементам двух групп с самым высоким вращением, поскольку публикация первого издания является результатом рассмотрения ситуации в свете нового понимания тенденции удельного вращения. Общий паттерн в Группе 4А сейчас видится как серии от 5-4½ до 4-4½, с возвращением к 4½-4½ у низких электроотрицательных элементов. Насколько определено сейчас, Группа 4В следует тому же паттерну, но продвинутому на один шаг, то есть она начинается с 4½-5, а не с 5-4½. Разница в межатомном расстоянии, соответствующая одному из шагов в процессе перехода, относительно мала. И в свете значительной вариации в экспериментальных величинах представлялось целесообразным принять во внимание вероятность комбинаций, таких как удельное вращение 4½-5 одного из пары атомов и 4½-4½ другого. Ясно, что такие комбинации существуют у некоторых элементов низких групп, например, у натрия, и, возможно, играют определенную роль в более высоких группах. Например, большинство зафиксированных расстояний у гольмия и эрбия лучше согласуются с комбинацией 5-4½ и 4½-5, чем с какой-либо из них по отдельности. Однако теоретически возможны все приведенные величины, и единственная проблема в этом и в других подобных случаях, какая теоретическая величина соответствует наблюдаемому расстоянию. Ответам на этот вопрос придется подождать оценки теоретических вероятностей или разрешения экспериментальных неясностей. Многим вопросам, касающимся структур альтернативных кристаллов, тоже придется подождать большей информации из теории или эксперимента, особенно если рассматриваются кристаллические формы, существующие лишь при высоких температурах или давлениях. Однако в этой области уже имеется большой объем информации. Ее можно связать с теоретической картиной, как только у кого-то появится время и желание выполнить эту задачу. Глава 1. Сцепление в твердых телах. Основные свойства материи Глава 1: Истоки | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Следствия переворота направления (в контексте фиксированной системы отсчета), который происходит в единице расстояния, в основном виде, обсуждались в главе 8 тома 1. Здесь, самым значимым следствием является то, что становится возможным установление равновесия между гравитацией и последовательностью естественной системы отсчета. Вне единицы расстояния имеется положение, в котором величины двух движений равны: расстояние, которое мы называем гравитационным пределом. Но положение равенства не является точкой равновесия. Напротив, это точка нестабильности. Если имеется хоть малейшая несбалансированность сил, результирующее движение усугубляет нестабильность. Например, небольшое движение вовнутрь усиливает силу гравитации, направленную вовнутрь и, тем самым, создает дальнейшее движение в том же направлении. Аналогично, если происходит небольшое движение наружу, это ослабляет силу гравитации и создает дальнейшее движение наружу. Хотя в точке гравитационного предела движения вовнутрь и наружу равны, эта точка – ни что иное, как граница между движением вовнутрь и движением наружу. Это не точка равновесия. В области внутри единицы расстояния, все наоборот. Влияние любого изменения положения противостоит несбалансированным силам, создающим изменение. Если имеется избыточная сила гравитации, происходит движение наружу, ослабляющее гравитацию и устраняющее несбалансированность. Если гравитационная сила неадекватна для поддержания равновесия, совершается движение вовнутрь. Это усиливает влияние гравитации и восстанавливает равновесие. До тех пор, пока не вмешиваются никакие внешние факторы, атомы движутся под действие гравитации, пока постепенно не оказываются внутри единицы расстояния других атомов. Затем в положениях в этой внутренней области устанавливается равновесие: мы назвали эту область областью времени. Условие, при котором ряд атомов занимает положения равновесия такого вида в совокупности, известно как твердое состояние материи. Расстояние между такими положениями – это межатомное расстояние, характерная черта каждой конкретной материальной субстанции, которую мы будем детально рассматривать в следующей главе. Смещения равновесия в любом направлении можно достичь лишь приложением некоего вида силы, а твердая структура сопротивляется либо силе, направленной вовнутрь, - сжатию, либо силе, направленной наружу, - упругости. Сила, с которой сопротивление упругости действует в целях предотвращения разделения атомов твердого тела, обычно известна как сила сцепления. Выводы, связанные с природой и происхождением атомного сцепления, сделанные в этой работе, заменяют знакомую теорию, основанную на других допущениях. Ранее принятая гипотеза, электрическая теория материи, уже частично рассматривалась в предыдущем томе. Но поскольку новое объяснение природы силы сцепления - главное для нынешнего развития, прежде чем мы продолжим детальнее развивать новую теоретическую структуру, будут представлены более исчерпывающие сравнения двух конфликтующих точек зрения. Электрическая или электронная теория постулирует, что атомы твердой материи электрически заряжены, и что сцепление между ними возникает за счет притяжения между разноименными зарядами. Основное подтверждение этой теории приходит из наблюдения поведения ионных соединений в растворе. Какая-то часть молекул данных соединений расщепляется или разлагается на противоположно заряженные компоненты, которые назвали ионами. Присутствие зарядов может объясняться любым из двух способов: (1) заряды существовали, но не обнаруживались в разложенном материале; (2) они возникли в процессе растворения. Приверженцы электрической теории основываются на объяснении (1). В то время, когда объяснение формулировалось впервые, считалось, что электрические заряды являются относительно постоянными сущностями, поэтому выводы об их роли в процессе растворения шли в ногу с современной научной мыслью. Однако потом обнаружили, что электрические заряды легко создаются, легко разрушаются и являются не более чем временной характеристикой материи. Это подрывало фундамент, на котором стоит главная опора электрической теории, но теория продолжала существовать из-за отсутствия какой-либо доступной альтернативы. Очевидно, что удерживать совокупность вместе должен какой-то вид силы. Кроме сил, известных как возникающие непосредственно из наблюдаемого движения, имеются лишь три вида силы, известные из определенного наблюдения: гравитационная, электрическая и магнитная. Так называемые “силы”, играющие важные роли в современной атомной физике, являются чисто гипотетическими. Из трех известных сил, лишь одна кажется достаточно сильной, чтобы рассматриваться как сцепление в твердых телах, - электрическая. Поэтому общей тенденцией в научных кругах стал вывод, что сцепление должно возникать за счет действия электрических сил, хотя серьезное подтверждение выводов, сделанных на основе процесса растворения, отсутствует и потому надежность под вопросом. Одним из серьезных возражений электрической теории сцепления является то, что на самом деле она вовсе не является цельной теорией, а представляет собой мозаику теорий. Одной и той же проблеме предлагается ряд разных объяснений. В своем основном виде, теория применима лишь к ограниченному классу веществ, так называемым “ионным” соединениям. Но огромное большинство соединений не являются “ионными”. Там, где отсутствуют гипотетические ионы, электрическую силу между ионами нельзя принимать в качестве объяснения сцепления. Поэтому, как свидетельствует один из химических трудов на полке автора: “Для рассмотрения образования этих соединений требуется другая теория”. Но и “другая теория”, основанная на странной концепции электронов, которыми “обмениваются” взаимодействующие атомы, не адекватна, чтобы иметь дело со всеми не ионными соединениями. Таким образом, для заполнения этого пробела было притянуто разнообразие дополнительных объяснений. В современном химическом языке, необходимость признания того, что каждое из разных объяснений в действительности является самостоятельной теорией сцепления, устраняется с помощью обозначения их как разных видов “связей” между атомами. Тогда, гипотетические связи описываются в терминах взаимодействия электронов так, что теории едины с точки зрения языка, но разные по содержанию. Как отмечалось в главе 19 тома 1, постулированы шесть или около того разных связей, наряду с “гибридными” связями, сочетающими характеристики общих видов. Даже при наличии всей широты дополнительных допущений и гипотез, некоторые вещества, в основном металлы, не могут приспосабливаться к этой теории с помощью любой специально изобретенной уловки. Общеизвестно, что металлы не содержат противоположно заряженных компонентов, если вообще содержат любые заряженные компоненты. И все же, они подвергаются действию сил сцепления, не отличимых от сил ионных соединений. Как счел необходимым признать в курсе лекций один из известных физиков В. Ф. Вайскопф: “Должен признаться, я не знаю, почему металлы удерживаются вместе”. Вайскопф указывает, что ученые не могут прийти к согласию даже в способе применения теории. Он говорит, что физики дают один ответ, химики – другой, но “ни один из ответов не адекватен для объяснения того, что такое химическая связь”.[1] Это весьма значимое положение. Факт, что сцепление металлов существует за счет чего-то другого, а не притяжения между разноименными зарядами, логически приводит к довольно обоснованному допущению, что атомное сцепление, в общем, не электрическое. Поскольку должно быть найдено не электрическое объяснение сцепления металлов, разумно ожидать, что объяснение будет применяться и к другим веществам. Опыт работы со сцеплением в металлах определенно предвещает выводы, сделанные в развитии теории Обратной Системы. Также заметили, что электрическая теория выдумана специально для этой цели. Помимо того, что экстраполяция условий, существующих в растворах, на твердое состояние, является лишь небольшой поддержкой теории, не существует никаких принципиальных допущений теории. В обычной материи не могло быть обнаружено существование электрических зарядов, даже в самых сильных ионных соединениях. Существование электронов как составляющих атомов – частая гипотеза. Допущение, что “нежелание” инертных газов входить в химические соединения указывает на то, что их структура особенно устойчива, абсолютно неуместно. Даже авторы идеи “обмена” электронами не предприняли попытки обеспечения любого значимого объяснения, что это значит, и как его можно достичь, если бы в атомной структуре действительно были бы электроны. Таковы допущения, на которых строится теория; они не имеют никакой эмпирической поддержки. Отсутствует и прочная основа, на что может претендовать эта теория, кроме того, что теоретические связи распространяются на ядерную теорию атомной структуры, которая сама по себе является чисто надуманным допущением. Эти положения, достаточно серьезные, могут рассматриваться как дополнительное свидетельство, как фатальная слабость электрической теории, которая была бы дискредитирована, даже если бы не стало известно нечто противоположной природы. Это наше знание поведения положительных и отрицательных зарядов, когда они находятся в тесной близости друг от друга. Такие заряды не устанавливают равновесие вида, постулированного в теории, они уничтожают друг друга. Нет свидетельства, указывавшего на то, что результат такого контакта иной в твердой совокупности, нет даже теории, почему следовало бы ожидать другого результата или как его можно было бы достичь. В этой связи, следует заметить: В то время как современная физическая теория рассматривает существование положительных и отрицательных зарядов в состоянии надлежащего общения (в ядерной теории атома и в электронной теории материи), она меняется и дает объяснения поведения антиматерии, когда заряды демонстрируют тот же жесткий антагонизм, что и при реальном наблюдении. Несостоятельность такого вида неминуемо возникает тогда, когда “непокорные” проблемы “решаются” на основе специально выдуманных допущений, включающих отход от установленных физических законов и принципов. В контексте нынешней ситуации, когда электронная теория оспаривается новым развитием, все недостатки и противоречия, свойственные электрической теории, становятся весьма значимыми. И позитивное свидетельство в пользу новой теории даже убедительнее, чем негативное свидетельство против ее предшественницы. Первый и, возможно, самый важный факт: Мы не заменяем электрическую теорию материи какой-то другой “теорией материи”. Обратная Система – это завершенная общая теория физической вселенной. Она не содержит никаких гипотез, кроме тех, которые относятся к природе пространства и времени. Она предлагает объяснение сцепления в твердых телах так же, как выводит логические и последовательные объяснения других физических явлений - просто с помощью развития следствий базовых постулатов. Поэтому, для рассмотрения сцепления нам не нужно призывать какую-то дополнительную силу гипотетической природы. Две силы, которые определяют ход событий в области вне единицы расстояния, аналогично принимаются в расчет для существования межатомного равновесия внутри этого расстояния. Значимо то, что новая теория определяет обе эти силы. Одним из главных недостатков электрической теории сцепления является то, что она рассматривает лишь одну силу - гипотетическую электрическую силу притяжения, в то время как для объяснения наблюдаемой ситуации требуются две силы. Сначала допустили, что атомы непроницаемы, и что электрические силы просто удерживают их в контакте. Современное знание сжимаемости и других свойств твердых тел разрушило эту гипотезу. Сейчас очевидно, что должно существовать нечто, что Карл Дарроу называл “антагонистом” в утверждении, приведенном в томе 1, чтобы противостоять силе притяжения (что бы это ни было) и создавать равновесие. Физики не смогли обнаружить такую силу, но развитие Обратной Системы раскрыло существование мощной и вездесущей силы, ранее неизвестной науке. Это и есть упущенный ингредиент в физической ситуации, сила, которая не только объясняет сцепление в твердой материи, но и, как мы видели в томе 1, дает ответы на, казалось бы, отдаленные проблемы, такие как структура звездных кластеров и разбегание галактик. Положение, которое следует особо отметить, таково: Именно эта доныне неизвестная сила (сила, возникающая за счет последовательности естественной системы отсчета) и удерживает твердую совокупность вместе, а не гравитация, действующая в противоположном направлении в области времени. Следовательно, превалирующее мнение, что сила гравитации слишком слаба, чтобы рассматриваться в качестве сцепления, неуместно, корректно оно или нет. Ввиду того, что новая теоретическая система применяет те же общие принципы к пониманию всех межатомных и межмолекулярных равновесий, она объясняет сцепление всех веществ одним и тем же физическим механизмом. Больше не нужно иметь одну теорию для ионных соединений, несколько других для не ионных соединений, и оставлять металлы вообще без любой теории. Теоретические находки в связи с природой химических соединений и структурой молекул, описанные в предыдущем томе, внесли огромный вклад в упрощение картины сцепления, поскольку устранили необходимость разных видов сил сцепления или “связей”. Все, что требуется от теории сцепления, - это объяснение межатомного равновесия, и оно предоставляется для всех твердых веществ при всех условиях – равновесие между гравитационным движением наружу (одна сила) и движением вовнутрь последовательности естественной системы отсчета (вторая сила). Из-за асимметрии паттернов вращения атомов многих элементов и соответствующей анизотропии распределений силы, положения равновесия варьируются не только между веществами, но и между разными ориентациями одного и того же вещества. Однако такие вариации влияют только на величины различных свойств атомов. Существенная характеристика межатомного равновесия всегда одна и та же. Как указывалось при обсуждении гравитации (в томе 1), хотя разные совокупности материи на самом деле не оказывают гравитационных воздействий друг на друга, наблюдаемые результаты их гравитационных движений совпадают с движениями, которые создавались бы, если бы такие силы существовали. То же самое справедливо и для результатов последовательности естественной системы отсчета. Имеется значимый элемент удобства в выражении этих результатов в терминах силы на основе “как бы”. Этой практике мы до некоторой степени следовали в предыдущем томе. Однако сейчас, когда мы готовы начать количественную оценку межатомных отношений, желательно прояснить, что концепция силы используется исключительно для удобства. Хотя последующее количественное обсуждение, как и предыдущее качественное обсуждение, будет выполняться в терминах сил, на самом деле мы будем иметь дело с движениями вовнутрь и наружу каждого индивидуального атома. В то время как упомянутые пункты убедительно свидетельствуют в пользу новой теории сцепления, самое впечатляющее подтверждение ее надежности приходит из способности определять точку равновесия, то есть, давать конкретные величины межатомных расстояний. Как будет продемонстрировано в главе 2, с помощью новых установленных отношений, мы уже можем вычислять вероятные величины межатомного расстояния для большинства более простых веществ, и, кажется, не должно быть никаких препятствий для расширения вычислений до более сложных веществ, если выполнению этой задачи уделить необходимое время и усилие. Кроме того, способность определить местонахождение точки равновесия не ограничивается простой ситуацией, когда вовлекаются лишь две базовые силы. Главы 4 и 5 покажут, что те же общие принципы можно использовать для оценки изменений в расстоянии равновесия, происходящих в результате применения теплоты или давления к твердой совокупности. Как указывалось в томе 1, хотя истинная величина единицы пространства везде одна и та же, действующая величина единицы пространства в регионе времени уменьшается на межрегиональное отношение. Эту уменьшенную величину, равную 1/156,44 естественной единицы, удобно рассматривать как единицу пространства в регионе времени. Действующая часть феномена региона времени может расширяться до одной или более дополнительных единиц, в этом случае измеренное расстояние будет превышать единицу региона времени, или первичная единица может действовать не полностью или не действовать вообще. В данном случае измеренное расстояние будет меньше, чем единица региона времени. Следовательно, внутриатомное равновесие может достигаться либо внутри, либо вне единицы расстояния региона времени, в зависимости от того, где внешние силы вращения достигают равновесия с внутренней силой последовательности естественной системы отсчета. Расширение межатомного расстояния за пределы одной единицы региона времени не выводит систему равновесия из региона времени, поскольку граница этого региона находится на расстоянии полноразмерной, естественной единицы, а не на расстоянии одной единицы региона времени. Следовательно, пока нас интересует сила межатомного равновесия, единица расстояния региона времени не представляет собой любой вид важности. Однако, как мы видели в исследовании состава магнитно-нейтральных групп, естественная единица, когда она существует в регионе времени (единица региона времени), является важной величиной с точки зрения ориентации. Объяснение этого различия можно вывести из рассмотрения различия в неотъемлемой природе двух явлений. Если межатомное расстояние меньше, чем одна единица региона времени, силы вращения действуют против силы движения вовнутрь последовательности естественной системы отсчета лишь в части единицы последовательности. Аналогично, если межатомное расстояние больше, чем одна единица региона времени, единица силы движения вовнутрь действует лишь против части, больше чем единица, сил вращения наружу. Следовательно, разницы в расстоянии отражают разницы в величинах сил вращения. Но влияние ориентации не обладает величиной. Оно либо существует, либо нет. Как мы отмечали в предыдущем обсуждении, а конкретно в связи со структурой молекулы бензола, действие, если оно существует, работает одинаково и вблизи и вдалеке. Существенное требование, которое должно удовлетворяться, - действие должно осуществляться непрерывно. В противном случае, в период бездействия ориентация разрушается. Если силы вращения превышают одну единицу региона времени, действие ориентации единицы совпадает лишь с частью общих сил вращения, эффект ориентации не является непрерывным, и ориентации не происходит. В этой главе, в основном, мы имеем дело с тем, что называем “силами вращения”. Это, конечно, те же “как бы” силы, возникающие за счет скалярного аспекта атомного вращения, которые назывались “гравитационными” в других контекстах. Выбор языка зависит от того, рассматриваем ли мы происхождение или действие силы, которая выделяется в обсуждении. Для количественной оценки сил вращения мы можем пользоваться общим уравнением силы, но заменяем обычные термины уравнения надлежащими терминами региона времени. Как объяснялось во введении концепции региона времени в главе 8 тома 1, эквивалент пространства 1/t заменяет пространство в регионе времени, тогда скорость представляет 1/t2. Энергия, одномерный эквивалент массы, которая занимает место массы в выражении уравнения силы в регионе времени, поскольку в этом регионе три движения атома работают отдельно, а не вместе, представляет собой обратное выражение или t2. Ускорение – это быстрота, деленная на время: 1/t3. Таким образом, эквивалентом уравнения F = ma в регионе времени является F = Ea = t2 x 1/t3 = 1/t в каждом измерении. Сейчас нам понадобиться рассмотреть природу приращения скорости в регионе времени. Во внешнем регионе, прибавления к смещению продолжаются в виде единиц: сначала одна единица, затем другая такая же единица, потом третья, и так далее. То есть, расстояние до любой конкретной точки представляет собой n единиц. У величины n нет термина, она появляется только как сумма. Прибавления в регионе времени следуют другому математическому паттерну, потому что в этом случае движется лишь один из компонентов движения, другие остаются фиксированными, то есть единицами. Здесь смещение равно 1/x, а последовательность представляет собой 1/1, 1/2, 1/3, …, 1/n. Величина 1/n – это последняя величина, а не сумма. Чтобы получить сумму, соответствующую n во внешнем регионе, величину 1/x необходимо интегрировать от x = 1 до x = n. Результатом будет натуральный логарифм n (ln n). Многие читатели первого издания спрашивали, почему сумма должна получаться посредством интегрирования, а не суммирования. Ответ таков: Мы имеем дело с непрерывным количеством. Как указывалось во вводных главах тома 1, движение, из которого построена вселенная, происходит не в виде последовательности скачков. Даже хотя движение существует только в единицах, это непрерывное движение. Единица движения – это определенная часть непрерывности. Серии единиц – это расширенный сегмент непрерывности, и его величиной является интеграл. Имея дело с базовыми индивидуальными единицами движения во внешнем регионе (регионе пространства), можно пользоваться процессом суммирования, но лишь потому, что в этом случае сумма совпадает с интегралом. Чтобы получить сумму серий 1/x, мы должны интегрировать. Чтобы вычислить силу вращения, мы интегрируем величину 1/t от единицы, физического исходного уровня или нулевого уровня, до t: Fr = ∫2 1/t dt = ln t (1 – 1) Если в любом измерении величина ln t меньше единицы, в данном измерении отсутствует сила, действующая наружу. Но натуральный логарифм превышает единицу для всех величин x больше 2-х, и атомы всех элементов обладают смещением вращения, равным 2 (эквивалент t = 3) или больше в, по крайней мере, одном измерении. Следовательно, все атомы обладают действующими силами вращения. Сила, вычисленная из уравнения 1 – 1, - это неотъемлемая сила вращения индивидуального атома; то есть, одномерная сила, которую вращение оказывает на одну единицу силы. Сила между двумя взаимодействующими атомами равна:
Для двумерного магнитного вращения сила становится
Как мы обнаружили в главе 12 тома 1, эквивалент расстояния s в регионе времени составляет s², следовательно, гравитационная сила в этом регионе меняется инверсно как четвертая степень расстояния, а не квадрат. Применяя этот фактор к выражению силы двумерного вращения, наряду с межрегиональным отношением, отношением к общей силе, выведенной в той же главе, мы получаем действующую силу магнитного вращения атома:
Фактор расстояния не применяется к силе из-за последовательности естественной системы отсчета, поскольку эта сила вездесуща, и в отличие от силы вращения, не меняется, когда объекты, к которым она относится, изменяют свои относительные положения. Поэтому, в точке равновесия сила вращения равна единице силы последовательности. Подставляя единицу вместо Fm в уравнение 1 – 4 и решая его для расстояния равновесия, мы получаем
Межатомные расстояния для элементов, не обладающих электрическим вращением, серии инертных газов, можно вычислить прямо из этого уравнения. Однако в большинстве случаев, у элементов tA = tB, и будет удобнее выразить уравнение в упрощенной форме:
Вычисленные величины находятся по соседству с 10-8 см, для удобства эта величина была взята за единицу для выражения межатомных и межмолекулярных расстояний. Будучи переведено из естественных единиц в традиционную единицу, единицу ангстрем, символ Ǻ, уравнение 1–6 принимает вид
Пользуясь этим уравнением, мы сталкиваемся с другим вопросом терминологии, который неминуемо возникает, когда любой теме дается новая трактовка. Значение величины t, используемое в предыдущем обсуждении и в уравнениях, очевидно из контекста, это величина действующего вращения. Но возникает вопрос: Как мы ее будем называть? Базовая величина, с которой мы имеем дело, смещение скорости вращения, не входит в уравнение напрямую. Математическая структура данных уравнений требует введения величин, включающих первичную единицу, которая составляет естественный нулевой уровень. Кроме того, каждая двойная вибрирующая единица вращается независимо, и когда вращение расширяется на вторую такую единицу, приращение величины t составляет лишь половину единицы на добавочную единицу смещения. При таких обстоятельствах, когда отношение термина t к смещению непостоянно, представляется желательным дать этому термину отдельное название. Поэтому мы будем называть его удельным вращением. Как говорилось при обсуждении общих характеристик атомного вращения в главе 10, том 1, два магнитных смещения могут быть не равными. В таком случае, распределение скорости принимает форму сфероида, с основным создаваемого вращением в двух измерениях и вспомогательным вращением в одном. При таких условиях, средняя действующая величина удельного вращения равна (t12t2)¹/3. В данном случае, мы имеем дело со свойствами одной сущности, и математическая ситуация кажется ясной. Но не так очевидно, как мы должны подходить к действующему удельному вращению, если имеет место взаимодействие между двумя атомами, чьи индивидуальные вращения разные. Так, как сейчас обстоят дела, представляется, что геометрическое среднее двух конкретных вращений и есть корректная величина. Однако следует заметить, что этот вывод, касающийся комбинаторной математики, еще пробный. И если дальнейшее изучение покажет, что его следует модифицировать в некоторых или всех применениях, вычисленные величины будут подвергаться соответствующей модификации. В большинстве случаев, любые изменения будут небольшими, но они станут значимыми, если между двумя компонентами имеется большая разница. Поэтому отсутствие основных расхождений между вычисленными и наблюдаемыми расстояниями в комбинациях атомов со многими разными измерениями оказывает значимую поддержку для использования геометрического среднего, в ожидании дальнейшего теоретического прояснения. Межатомные расстояния четырех из пяти элементов инертного газа, для которых имеются экспериментальные данные, следуют правильному паттерну. В Таблице 1 приводится сравнение величин, вычисленных для этих элементов, с экспериментальными расстояниями.
Гелий, который тоже принадлежит к инертным газам, обладает особыми характеристиками за счет низкого вращательного смещения, и будет обсуждаться в связи с другими элементами, на которые влияют те же факторы. Причина появления величины 4¹/2 у вращения ксенона будет объясняться позже. Вычисленные расстояния – это такие расстояния, которые превалировали бы при отсутствии сжатия и термального расширения. Исследователи экстраполировали некоторые экспериментальные данные на нулевую основу, но большинство приведенных величин - это реально наблюдаемые величины при атмосферном давлении и температурах, зависящие от свойств наблюдаемых веществ. Эти величины не совсем сравнимы с вычисленными расстояниями. Однако, в общем, расширение и сжатие в результате температуры и давления наблюдения невелики. Сравнение величин в двух последних колонках таблицы 1 и аналогичных таблиц в главах 2 и 3 дает хорошую картину степени согласованности между теоретическими цифрами и экспериментальными результатами. Еще одно положение о корреляциях, которое следует принимать во внимание, - это значимое количество расхождения в экспериментальных результатах. Если бы мы взяли самые близкие из измеренных величин за основу сравнения, корреляции были бы намного лучше. Например, одно относительно позднее определение расстояния ксенона приближается к величине 4,34, почти совпадая с вычисленным расстоянием. Также, зафиксированы величины для расстояния аргона, которые более тесно согласуются с теоретическим результатом. Однако общая политика использования ближайших величин привела бы к стремлению, чтобы корреляции выглядели бы более благоприятными, чем реально имеющаяся ситуация. Поэтому, сочли полезным пользоваться эмпирическими данными из осознанного выбора предпочтительных величин. За исключением величин, помеченных звездочками, все экспериментальные величины, приведенные в таблицах, взяты из подборки Уискоффа.[2] Конечно, использование величин, выбранных на основе косвенных критериев, уводит стремление в неблагоприятном направлении, поскольку, если теоретические результаты верны, каждая экспериментальная ошибка показывается как расхождение. Но даже при этой негативной склонности, согласование между теорией и наблюдением достаточно тесное для того, чтобы показать, что теоретическое определение межатомного расстояния в принципе корректно, и продемонстрировать, что за исключением относительно небольшого ряда неясных случаев, оно корректно в детальном применении. Сейчас, возвращаясь к элементам, обладающим как электрическим, так и магнитным смещением, вновь заметим, что электрическое вращение одномерно и противоположно магнитному вращению. Поэтому выражение для действия силы электрического вращения на магнитно вращающийся фотон мы получаем с помощью инверсии одномерной силы уравнения 1 – 2.
Ввиду того, что электрическое вращение не является независимым движением базового фотона, а вращением магнитно вращающейся структуры в обратном направлении, сочетание уравнения силы электрического вращения 1 – 8 с уравнением силы магнитного вращения 1 – 4 меняет только термины вращения (функции t) и оставляет остаток уравнения неизменным.
Здесь, вновь, в точке равновесия, действующие силы вращения (наружу) и силы последовательности естественной системы отсчета (вовнутрь) обязательно равны. Поскольку сила последовательности естественной системы отсчета равна единице, мы подставляем эту величину для F в уравнение 1 – 9 и, как прежде, решаем его для расстояния равновесия s0.
И вновь, упрощая для применения к элементам, у которых А обычно равно В, получаем:
И в единицах ангстрем это будет:
Как уже замечалось, когда вращение распространяется на вторую (двойную) вибрирующую единицу, на вибрацию два, можно сказать, что каждая единица добавочного смещения прибавляет к удельному вращению лишь половину единицы. Ввиду того, что 8 трехмерно распределенных единиц электрического смещения приводят вращение к новой нулевой точке и заставляют вращательное движение превращаться в поступательное, изменение вибрации два в электрическом измерении должно иметь место прежде, чем смещение достигает 8. Следовательно, за удельным вращением 8 (смещение 7) следует 8¹/2, 9, 9¹/2, и так далее. Но первая действующая единица смещения вращения обязательно одномерна, и линейный эквивалент 8-единичного предела равен 2 единицам. Последующее смещение единиц обладает вариантом продолжения на одномерной основе и расширением вращения до вибрации два, а не расширением в дополнительные измерения. Поэтому, изменение вибрации два может происходить сразу же после первой единицы смещения. В таком случае, за удельным вращением 2 (смещение 1) следует 2¹/2, 3, 3¹/2, и так далее. Более низкая величина обычно обнаруживается, как только впервые ставится возможной; то есть, смещение 2 обычно соответствует вращению 2¹/2, а не 3. Следующий элемент может занимать промежуточную величину 3¹/2, но выше этой точки обычно превалируют более высокая вибрация один. В первом издании мы указывали, что объединение одной или двух единиц вибрационного смещения не обязательно составляет весь вибрационный компонент базового фотона ввиду того, что эти одна или две единицы способны вращаться независимо от остальных вибрационных единиц, если таковые имеются. Сейчас, дальнейшее рассмотрение привело к выводу, что одна или две единицы частоты много единичного фотона фактически могут устанавливать вращение независимо, как указывалось раньше, и что первичный фотон может обладать избытком вибрационных единиц. Но в таком случае, вращающаяся часть фотона начинает движение вовнутрь, в то время как не вращающиеся части продолжают движение наружу по причине наличия последовательности естественной системы отсчета. Следовательно, две части разделяются, и вращающаяся часть сохраняет не вращающийся вибрационный компонент. Общий паттерн магнитно вращающихся величин такой же, что и у электрических величин. Тенденция заменять удельное вращение 2¹/2 на 3 относится и к магнитному вращению, и в комбинациях более низкой группы (и элементов и соединений), следующих обычному электроположительному паттерну, конкретные магнитные вращения обычно 2¹/2–2¹/2 или 3–2¹/2, а не 3-3. Но верхний предел удельного магнитного вращения на основе вибрации один равен 4 (трем единицам смещения) вместо 8, поскольку двумерное вращение достигает верхнего нулевого уровня 4-х единиц смещения в каждом измерении. Поэтому в обычной последовательности, за вращением 4¹/2 следует вращение 4, что мы и видели в величинах для ксенона в таблице 1. Однако в одном измерении можно достичь вращения 5 и без доведения магнитного вращения в целом до уровня 5. Вращение 5–4 или 5–4¹/2 происходит в некоторых элементах либо вместо, либо в комбинации с вращением 4¹/2-4 или 4¹/2–4¹/2. Предисловие Предисловие Этот том – второй из серии книг, в которых я предпринимаю попытку развить следствия, неизбежно вытекающие из постулата, что физическая вселенная целиком и полностью составлена движением. Характеристики базового движения определены в первом томе серии Ничего кроме движения в виде семи допущений, относящихся к природе и взаимодействию пространства и времени. В дальнейшем развитии, посредством логических и математических процессов, из приведенных допущений выведены необходимые следствия, без каких-либо вспомогательных допущений и введения чего-либо из опыта. Наряду с теоретическим развитием, было продемонстрировано следующее. Сделанные выводы согласуются со значимыми данными, полученными в результате наблюдения и эксперимента, где бы ни делалось сравнение. Это оправдывает предположение, что в той степени, в которой выполнено развитие, теоретические результаты представляют истинную и точную картину реальной физической вселенной. В теоретическом развитии подобной природы, начиная с постулата о фундаментальной природе вселенной, первые результаты процесса дедукции обязательно принимают форму выводов базового характера: структуры материи, природы электромагнитного излучения и так далее. Ввиду того, что эти явления нельзя постичь напрямую, предыдущим исследователям пришлось формулировать теории с помощью специально выдуманных допущений в каждой отдельной области для увязывания с доступной, косвенной информацией. Самое лучшее, что может сделать корректная теория в любой из отбельных областей, - прийти к результатам, согласующимся и с доступной эмпирической информацией. Поэтому, полное значение нового развития невозможно постичь до тех пор, пока не будет осознано, что новая теоретическая система, как мы ее называем Обратная Система, обладает общим применением, и является теорией, которая приходит ко всем выводам во всех областях физики с помощью дедукции из одного и того же набора основных допущений. Опыт показал, что большинству людей трудно обрести достаточно широкий взгляд на основы многих разных областей физической науки, чтобы полностью оценить единый характер новой системы. Однако, по мере продолжения дедуктивного развития, взгляд постепенно расширяется в более знакомые области, где эмпирическая информация доступнее и меньше подвергается случайному приспособлению или интерпретации для увязывания с превалирующими теориями. Чем больше продвигается развитие новой общей физической теории, тем очевиднее становится ее правомочность. Это особенно верно в тех случаях (являющихся предметом обсуждения в этом томе), когда теоретические умозаключения обеспечивают и объяснения и числовые значения в областях, недоступных из традиционных источников. Между публикацией тома 1 и первым полным изданием тома 2 прошло восемь лет. Ввиду того, что исследование, результаты которого представляются, продолжается, за это время накопилось огромное количество новой информации. Оно расширяет или проясняет некоторые темы первого тома, и, поскольку приняты во внимание новые находки, связанные с темами данного тома, в нем потребовалось обсудить относящиеся к делу аспекты, хотя некоторые из них могут показаться не к месту. Если и когда предпринимается пересмотр первого тома, этот материал будет переноситься в том 1. Первые 11 глав данного тома были опубликованы в виде воспроизведения рукописных страниц в 1980 году. Публикация первого полного издания стала возможна в результате усилий группы членов Международного Сообщества Единой Науки, включая Рейнера Хака, обеспечившего финансирование, Фила Портера, отвечавшего за печатание, Идена Муира, подготовившего иллюстрации, и Джен Семмер, отвечавшей за проект. Д. Б. Ларсон Декабрь 1987 года. Глава 21. Кольцевые соединения Ничего, кроме движения Глава 21: Кольцевые соединения Вторая основная группа органических соединений – кольцевые соединения. И вновь, кольцевые структуры делятся на три подгруппы. В двух из них положительными компонентами магнитно-нейтральных групп являются атомы углерода. Первая подгруппа – это циклические или алициклические соединения, у которых преимущественная валентность углерода равна 2. Вторая подгруппа – это ароматические соединения, у которой валентность углерода равна 1. У третьей подгруппы - гетероциклические соединения - один или больше атомов углерода в кольце заменяется атомом какого-то другого элемента. Эти три подгруппы подразделяются еще на мононуклеарные и полинуклеарные подразделения; базовая структура последних формируется посредством уплотнения (сгущения) или слияния двух или более колец. Следует понять, что подразделения не исключают друг друга. Соединение может состоять из кольца, присоединенного к одной или более цепей; цепное соединение может обладать одной парафиновой и одной олефиновой ветвью; циклическое кольцо может присоединяться к ароматическому кольцу, и так далее. Как и у цепных соединений, классификация делит кольцевые соединения на семейства, характеризующиеся природой отрицательных компонентов, - углеводороды, спирты, амины и так далее. Обыкновенный циклический углеводород циклан или циклопарафин – это простое кольцо нейтральных групп CH2. Общую формулу можно выразить как -(CH2)n. Начиная с циклопропана (n= 3), обыкновенные цикланы создаются всеми величинами n, вплоть до более 30. У колец нейтральные группы идентичны нейтральным группам CH2 у цепных соединений и могут расширяться тем же способом – прибавлениями CH2. Следовательно, разветвленным цепным соединениям соответствуют разветвленные кольца, такие как этилциклогексан -(CH2)5 (CH • CH2 • CH3)- и 1-метил-2-этил циклопентан -CHCH3 • (CH • CH2 • CH3) • (CH2)3. В последующих обозначениях нейтральные группы будут четко определены скобками или другими средствами, и (как и в нейтральных группах цепных соединений) внутри групп будет сохраняться положительно-отрицательных порядок. Чтобы определить вещество как кольцевое соединение и показать, что конечные положения в прямой строке формулы не имеют такой особой значимости, как в цепных соединениях, на каждом конце кольцевой формулы будет использоваться тире, как в вышеприведенных примерах. Если имеются два или более кольца или если часть соединения находится вне кольца, на это будут указывать положения тире. Поскольку при выражении формулы единичного кольца ни одна группа не может считаться стартовой точкой, по возможности, мы будем следовать порядку обычной системы нумерации, чтобы снизить до минимума отклонения от известной практики. То есть, названия ветвей, например, 1-метил-2этил, будут ясно указываться формулой. У циклического кольца замещение всех двухвалентных групп одновалентными группами там, где замещение реально, преобразовывает циклическое соединение в ароматическое. Однако отдельные ароматические характеристики не появляются до тех пор, пока не завершится замещение. Поэтому в циклическую классификацию будут включены промежуточные структуры, у которых CH или ее эквивалент замещены на CH2 только в части кольцевых положений. Поскольку присутствие оставшихся групп CH2 является главным определителем молекулярных свойств, превалирующей валентностью углерода, в том смысле, в каком этот термин используется для определения классов кольцевых соединений, будет 2, даже если в молекуле имеется больше групп СН, чем CH2. Как уже упоминалось, в молекулярных соединениях вероятности благоприятствуют объединению подобных сил. Группы CH2 обладают достаточной гибкостью геометрической компоновки для компенсации существенных вариаций. Следовательно, единичные группы CH2 могут без труда увязываться с молекулярной структурой. Группы СН обладают небольшим геометрическим дрейфом, и поэтому они почти всегда существуют в парах. Это не значит, что индивидуальная группа не может существовать отдельно, и в некоторых более сложных структурах можно обнаружить единичные группы СН. Но у простых колец пары настолько вероятнее, чем нечетные количества групп, что последние исключаются. Первое двухгрупповое замещение в цикланах создает циклены или циклоолефины. Типичное соединение - циклогексан -(CH2)4 • (CH)2. Исходя из выводов этой работы, производные циклопарафина и циклоолефина невозможны, поскольку циклопарафины не содержат атомов углерода с характеристиками валентности парафина. Циклоолефины формируются замещением двухвалентных групп ацетилена на кольца CH2. Поэтому предпочтительнее названия циклан и циклен. Замещение еще двух групп СН в кольце создает циклодиены. Существование двух пар CH • CH в этих соединениях вносит новый фактор - положения пар внутри кольца могут меняться. В связи с циклопентадиеном (CH)Q•CH2 - первым соединением в этих сериях - вопроса не возникает, но у циклогексадиена возможны две разные компоновки: -(CH)4• (CH2)2, известная как 1,3-циклогексадиен, и -(CH)2 • CH2 • (CH)2 • CH2, являющаяся 1,4-циклогексадиеном. У циклических соединений отрицательные атомы водорода могут замещаться эквивалентными атомами или группами так же, как отрицательные атомы водорода, содержащиеся в магнитно-нейтральных группах цепных соединений. Конечные продукты, такие как циклогексил хлорид -(CH2)5 • CHCI-, циклогексанол -(CH2)5 • CHOH-, циклогексаламин -(CH2)5 • CHNH2, и так далее, обладают свойствами, похожими на свойства эквивалентных цепных соединений - хлоридов, спиртов, аминов и так далее. У обычных циклических колец нет атомных групп, обладающих свободой геометрической компоновки, сравнимой со свободой радикалов на обоих концах алифатических цепей. И заменители (у цепей ограниченные радикалами) совсем не появляются у циклических соединений до тех пор, пока ветвь не становится достаточно длинной для того, чтобы поместить конечную группу вне действия сил, возникающих в кольце. В этом случае структура действует как комбинация цепного и кольцевого соединения. Из-за геометрического ограничения область заменителей у обычных видов циклических соединений значительно уже, чем у цепей. Кроме вышеупомянутых CI, OH и NH2 список включает оставшиеся галогены, кислород, CN и CO • OH. Соединения, образованные прямым замещением двух атомов водорода группы CH2 на кислород называются кетонами, но они не обладают кетонной структурой, поскольку возникающая группа СО становится частью кольца и магнитно-нейтральной группой. Первое замещение создает циклогексанон -(CH2)5 • CO-. Второе замещение создает соединение 1,3-циклогександион -CO • CH2 • CO • (CH2)3-. Замещение СО может расширяться до циклогексан гексона -(CO)6, у которого уже не остается водорода. Также кислород может быть одновалентным, вместо двухвалентного; в таком случае мы получаем такое соединение как циклогексил метил эфир -(CH2)5 • (CH • OCH3)-. Дополнительные семейства соединений создаются как вторичными замещениями, выливающимися в структуры порядка циклогексил ацетата -(CH2)5 • CH(O • CO • CH3)-, так и параллельными замещениями двух или более нейтральных групп. Примером вида структуры, создающейся множественными замещениями, является 1,2,3-циклопропанэтрикарболсиловая кислота -(CH • CO • OH)3-. Естественно возникающие соединения этого циклического класса являются сильно ветвящимися кольцами, начиная с таких соединений как ментол -CHCH3 • CH2 • CHOH • (CH • CHCH3 • CH3) • (CH2)2 и кончая очень сложными структурами. Но все они следуют тем же общим структурным паттернам, что и более простые циклические соединения. Поэтому дополнительное обсуждение не требуется. Как уже упоминалось, группы CH2 обладают значительной степенью структурной широты за счет трехатомного состава. Угол между действующими линиями силы варьируется от почти 120º у циклопропана до менее 15º у самых больших циклических колец, изученных до настоящего момента. Двухатомные группы, такие как СН, не обладают такой структурной свободой и ограничены узкой областью вблизи 60º. Теоретически, точные пределы еще не установлены, но трудности, связанные с созданием производных циклооктатэтрина -(CH)8, указывают, что это соединение пребывает на пределе устойчивости. Это допускало бы максимальное отклонение почти 15º от угла в 60º у кольца, состоящего из шести членов. Атомы, из которых состоят молекулярные соединения, обладают ограниченной областью, в которой они могут принимать положения выше или ниже центральной плоскости молекулы. Поэтому реальные углы между действующими линиями силы слегка отклоняются от вышеприведенных цифр, основанных на положениях в центральной плоскости. Но это не влияет на следующий вывод: циклическое кольцо очень гибкое, а ароматическое кольцо практически жесткое. До тех пор, пока у кольца имеется хотя бы одна группа CH2, оно обладает циклической гибкостью. Несмотря на жесткость части кольца, занимаемой четырьмя группами СН, циклопентадиен существует потому, что группа CH2, завершающая структуру, может приспосабливаться к положению, необходимому для закрытия кольца. Но если все трехатомные группы замещены двухатомными группами или единичными атомами, кольцо становится таким же жестким, как ароматическое. Например, циклобутадиен состоял бы только из четырех групп CH2, и максимальное отклонение линий силы СН (где-то рядом с 75º) меньше, чем 90º, которое потребовалось бы для закрытия циклобутадиенового кольца. Поэтому все попытки создать такое соединение потерпели неудачу. Свойства разных кольцевых соединений в значительной степени зависят от следующего фактора: ограничиваются ли члены колец некими определенными положениями или обладают существенным диапазоном изменчивости, внутри которого они могут приспосабливаться к требованиям для соединения. В свете естественной пограничной линии ароматическая классификация (как она используется в этой работе) ограничивается жесткими структурами, особенно соединениями, полностью состоящими из одновалентных групп СН или их одновалентных заместителей, исключая структуры, связанные с вероятно присутствующими атомами углерода. Из-за ограничений на положения атомов ароматические соединения (за исключением циклооктатэтрана) ограничиваются шестичленными кольцами, одновалентными эквивалентами циклогексана и его производными, а циклобутан, циклогептан и так далее не имеют ароматических аналогов. Структурная жесткость в значительной степени ограничивает подвижность атоматических колец в образовании соединений, но это компенсируется другими влияниями того же фактора. Положения в цепных соединениях, открытые наибольшему разнообразию положений, - это концы цепи и более длинные ветви, если таковые имеются. У ароматических колец положение каждого кольца до некоторой степени обладает свойствами конца. Вследствие негибкости кольца максимальное расстояние между группами 1-3 в кольце на 10% меньше, чем расстояние между эквивалентными группами в алифатической цепи после принятия в расчет небольшой существующей гибкости. Это позволяет некоторые дополнительные комбинации элементов в пределах действия свободных электрических смещений. У этих колец мы находим не только группы COH, CCI, CNH2 и так далее - одновалентные эквиваленты комбинаций, составляющих циклические кольца и внутренние части цепных соединений, но и другие комбинации, такие как CNO2 и CSH, пребывающие выше магнитно-нейтральных пределов у неароматических структур. Количество доступных комбинаций, у которых нейтральная группа СО сопровождает отрицательный радикал, тоже увеличивается. Вторичные замещения увеличивают длину и расширяют разнообразие магнитно-нейтральных групп кольца, что создает широкое разнообразие одноветвистых соединений порядка изобутил бензола -(CH)5 • (C • CH2 • CHCH3 • CH3)- и N-этила анилина -(CH)5 • (C • NH • CH2 • CH3)-. Основная причина разнообразия мононуклеарных ароматидов - способность к множественному ветвлению. Ароматические кольца обладают не только большим разнообразием доступных заместителей, чем любой другой вид молекулярного соединения, но и большим количеством положений, куда можно вводить эти заместители. Такая подвижность осложняется тем, что у колец, как и у цепей, порядок последовательности групп обладает определенным влиянием на свойства соединения. Например, поведение 1,2-дихлорбензола -(CCl)2•(CH)4, во многих отношениях сильно отличается от поведения 1,4-дихлорбензола -CCl • (CH)2 • CCl • (CH)2. Значимой характеристикой ароматических колец является способность использовать большее количество менее подвижных заместителей. Например, сведение таких групп, как NO2, к роли отрицательного радикала в цепях означает, что в любом цепном соединении может существовать лишь одна такая группа до тех пор, пока ветвь не становится настолько длинной, что соединение действует как союз двух цепей. У ароматического кольца такое ограничение отсутствует, и весьма распространены соединения с тремя или четырьмя высоко реактивными азотными группами у кольца из шести членов. Список включает такие известные вещества как пикриновая кислота (2,4,6-тринитрофенол) -COH • CNO2 • CH • CNO2 • CH • CNO2-, и тротил (2,4,6-тринитротолуол) -CH3 • CNO2 • CH • CNO2 • CH • CNO2-. У ароматических колец, поскольку в группе СН имеется лишь один атом водорода, заместители ограничены одновалентными, отрицательными компонентами. Для установления валентного равновесия с двухвалентным атомом или радикалом требуется два ароматических кольца. Поэтому двухвалентные атомы или группы создают способы объединения двух колец. Например, дифенил эфир обладает структурой -(CH)5 • C-OC • (CH)5-, у которой атом кислорода не является членом ни одного кольца, но участвует в валентном равновесии. Аналогично, двухвалентный, отрицательный радикал NH создает дифенил амин -(CH)5 • C-NH-C • (CH)5-. Каждое из колец является очень устойчивой структурой с минимум одиннадцатью заменяющими атомами и вероятностью значительного увеличения посредством замещения. Таким образом, такой способ объединения колец - довольно доступный процесс строительства молекул большого размера. Дальнейшие прибавления и замещения можно делать не только в кольцах и их ветвях, но и в связующих звеньях между ними. Так, прибавление двух групп CH2 к дифениловому эфиру создает дибензил эфир -(CH)5 • CCH2 • O • CH2 C • (CH)5-. Согласно определению ароматического соединения, такие многокольцевые структуры не являются чисто ароматическими, поскольку под определение не подходят связующие звенья. Мы столкнемся с этой ситуацией, несмотря на то, как создаются разные органические классификации, поскольку более сложные соединения являются преимущественно комбинациями разных основных видов структуры. Обычно соединение классифицируется как кольцевая структура, если оно содержит кольцо любого вида, даже если кольцо может быть лишь небольшим придатком на длинной цепи. Соединение считается ароматическим, если присутствует, по крайней мере, одно ароматическое кольцо. У многокольцевых соединений комбинация (CH)5 • C - бензоловое кольцо меньше одного атома водорода - действует как одновалентный, положительный радикал - радикал фенила, и простые замещенные соединения могут называться либо производными бензола, либо соединениями фенила; то есть, хлорбензолом или фенил хлоридом. Общая положительная одновалентность – это валентное условие, при котором кольцо сохраняется, если убирается атом водорода; но общая валентность создается в основном за счет валентности +1 одного атома углерода, от которого отделяется атом водорода. Все остальные группы остаются нейтральными, но из этого необязательно следует, что валентность углерода останется +1. Как уже подчеркивалось, валентность – просто вопрос ориентации вращения, и, действуя в одиночку, любой атом может принимать любую из возможных валентностей, если в окружающей среде не существует никаких определенных препятствий. Поэтому один атом углерода свободно приспосабливается к разной окружающей среде посредством переориентации на основе любой из альтернативных валентностей: +2, +4 или –4. Если соединяются два радикала фенила, межатомные силы будут стремиться установить равновесие. Предпосылка для равновесия сил - равновесие валентности. Следовательно, атомы углерода будут переориентироваться так, чтобы сбалансировать валентности. Имеются два возможных способа достижения результата. Поскольку углерод обладает лишь одной отрицательной валентностью (–4), один атом углерода принимает эту валентность, второй атом должен принимать валентность +4, чтобы прийти к равновесию. У комбинации двух фениловых групп валентные изменения могут происходить у двух независимых атомов углерода без всякой модификации нейтральных групп. Поэтому это самая вероятная структура в таких соединениях как бифенил -(CH)5 • C-C • (CH)5-. Для формирования азобензола -(CH)5 • CNNC • (CH)5- в комбинацию с четырехвалентными атомами углерода можно ввести аналогично сбалансированные пары атомов азота с положительной и отрицательной валентностью 3. Альтернатива - совершение обоих валентных изменений в той же группе фенила, придавая одному атому углерода валентность (–4) и увеличивая валентность атома углерода в соседней, нейтральной группе от +1 до +4. Результат – кольцо с четырьмя нейтральными группами СН: группой СН с результирующей валентностью +3 и единичным атомом углерода с валентностью (–4). С помощью этой операции группа фенила меняется с одновалентного, положительного радикала C • (CH)5 до одновалентного, отрицательного радикала (CH)4 • CH • C. Подобно группе метила, которая может действовать либо как положительный радикал CH3 с валентностью +1, либо как отрицательный радикал CH2 • H с валентностью (–1), группа фенила способна соединяться с веществами любого вида валентности, принимая отрицательную валентность в комбинации с положительным компонентом и положительную валентность в комбинации с отрицательным атомом или группой. Она отрицательная во всех соединениях фенила металлоорганического класса и образует не только такие соединения, как фенил меди Cu-C • (CH)5- и дифенил цинка Zn(-C • (CH)5-)2, но и комбинации фенил-галоидных структур, такие как фенил олова трихлорид SnCl3-C • (CH)5-. В комбинации с радикалом CH3 группа фенила положительная. Любой радикал может принимать любую валентность, но вероятности группы метила почти равны, а у группы фенила вероятнее положительная валентность, поскольку кроме удаления атома водорода в бензоловом кольце не совершается никакое изменение. Поэтому комбинация -(CH)5 • CCH3- является толуолом с положительным фенилом и отрицательным метилом (двухвалентным углеродом), а не фенил метаном с отрицательным фенилом и положительным метилом (четырехвалентным углеродом). Эта разновидность недоступна в комбинации с другими углеводородными радикалами или с самим углеродом. В таких соединениях радикал фенила заменяет водород и является отрицательным. Например, дополнительные замещения фенила сводят радикал CH3 к радикалу CH2. Эта группа не может иметь результирующую валентность (–2), которая понадобилась бы для соединения с положительными радикалами фенила, и у получающегося соединения – дифенил метана - обе группы фенила принимают отрицательный статус. Аналогично, олефиновые и ацетиленовые бензолы обладают такой структурой, у которой радикал фенила отрицательный. Например, стирол – это не винилбензол -(CH)5 • C-CH2 • CH, поскольку эта комбинация содержала бы два положительных компонента и ни одного отрицательного. Это фенил этилен CH • CH2 • -C • (CH)5-, у которого СН положительна, а группа фенила отрицательна. Интересное соединение фенила – фенил ацетилен, традиционная формула которого C6HS • C • CH. На основании нашего вывода, что водород отрицателен к углероду, атом водорода в ацетилене СН был бы отрицательным. Но это не так, поскольку его можно заменить натрием. Тогда кажется очевидным, что это фенил карбид -(CH)5 • CC2H - соединение аналогичное бутадиену, которое мы уже определили как карбид C • CH • C2H. Как уже замечалось, относительная отрицательность углерода и водорода не имеет значения в связи с радикалом карбида, обладающим результирующей, отрицательной валентностью, и не может быть никакой другой, кроме отрицательной, невзирая на то, с каким элементом или группой он соединяется. Согласно учебникам, соединение фенила определяется как ацетилен потому, что “вступает в типичные реакции ацетилена”. Но то же самое делает любой другой карбид. У первых велосипедистов ацетиленовая лампа была “карбидной лампой”. Как и радикал фенила, циклические радикалы могут приспосабливаться либо к положительному, либо отрицательному положению в молекуле. Эти радикалы положительны в монозамещенных соединениях. Замещение метила создает гексгидротолуол, а не циклогексил метан. Но если в группе метила имеются два циклических замещения, оба они отрицательные, а результат - дициклогексил метан. Сейчас было бы желательно исследовать влияния разных модификаций кольцевой структуры на сцепление молекулы. За основную ароматическую структуру можно принять бензоловое кольцо. Учебники и монографии по ароматическим соединениям обычно содержат главу или, по крайней мере, обширный раздел о “проблеме бензола 69”. По существу, проблема в следующем: все сообщения, основанные на наблюдении и эксперименте, указывают на то, что межатомные силы и расстояния между любыми двумя из шести групп СН в кольце идентичны. Но теория химической “связи” не способна рассматривать структуру молекулы бензола, не используя два или более вида связей. Современное решение проблемы – смести ее под ковер посредством допущения, что при переходе от одной компоновки к другой связи структуры меняются или “резонируют”. СТОВ показывает, что силы между группами в бензоловом кольце действительно идентичны. Однако, как подчеркивалось в предшествующем обсуждении, существование и природа химических соединений не определяются силами сцепления между атомами различных элементов, а отношениями направлений, которые могут принимать вращения атомов, чтобы позволить элементам с электрическим вращением во времени устанавливать устойчивые равновесия сил в пространстве. Результаты теории согласны с тем, что влияния ориентации, позволяющие группам СН комбинироваться в бензоловое кольцо, принимают два разных вида: ближнее и дальнее. Также они раскрывают, что природа ориентирующих влияний не оказывает действия на величину межатомных сил. И это объясняет, почему разница между этими силами не может быть обнаружена экспериментально. Силы между двумя любыми нейтральными группами СН идентичны. Поскольку факторы ориентации вынуждают атомы выравнивать вращение в конкретных особых относительных направлениях, в определенном смысле они являются силами. И чтобы отличить их от реальных сил сцепления, удерживающих вместе атомы, группы и молекулы в положениях, определенных факторами ориентации, применительно к ориентации мы будем пользоваться термином ”влияния”, а не “силы”, хотя это внесет в изложение элемент неуклюжести. Природу влияний в связи с бензоловым кольцом можно проиллюстрировать схемой ориентации, уже представленного вида.
На схеме пары групп CН 1-2, 3-4 и 5-6, удерживаются в комбинированных положениях влияниями ориентации направленного характера, которые оказываются всеми магнитными группами или соединениями. Альтернативные группы 1-3, 2-4 и так далее пребывают в пределах единицы расстояния, и, следовательно, в пределах действия влияний ориентации. Например, первичное влияние группы 1 направлено к группе 2, но группа 3 тоже пребывает внутри единицы расстояния. Поэтому имеются дальнее вторичное влияние 1-3 и ближнее первичное влияние 1-2. Вследствие направленной природы влияний ориентации, первичное влияние 2-3 отсутствует, но пары 1-2 и 3-4 удерживаются в положениях, обусловленных вторичными влияниями 1-3 и 4-2. Если заменить один из атомов водорода на какой-то отрицательный заместитель, ситуация ориентации не изменится. Новая нейтральная группа или та часть ее, которая пребывает в пределах действия сил кольца, если группа длинная, берет на себя функции неизмененной группы СН. Однако удаление атома водорода и преобразование молекулы бензола в положительный радикал фенила меняет паттерн ориентации:
Сейчас вторичное влияние 3-5 устранено, поскольку единичный атом углерода не обладает характеристикой свободного электрического вращения магнитных групп или соединений, но оставшихся влияний ориентации еще достаточно для удержания структуры вместе. Дальнейшее изменение валентности, необходимое, если радикал фенила принимает отрицательную валентность, устраняет вторичное влияние 4-2, поскольку группа 4 больше не является магнитной. Два атома углерода и один атом водорода объединяются в радикал ССН, результирующая валентность которого составляет (–1). Этот радикал не оказывает ориентирующего влияния на соседей, но на него влияют соседние, магнитно-нейтральные группы. Паттерн ориентации принимает вид:
Как уже объяснялось, атомы углерода в комбинации ССН обладают валентностями +4 и (–4). Убирая атом водорода из этой группы, мы получаем кольцо, у которого четыре нейтральные группы СН комбинируются с двумя индивидуальными атомами углерода. Эта структура нейтральна и способна существовать как независимое соединение. В отличие от молекулы метилена она так и поступает, потому что обладает сильной тенденцией к формированию двойного кольца. Четыре группы СН, примыкающие к комбинации С-С, могут дублироваться на противоположной стороне линии действия С-С, формируя еще одно подобное кольцо, использующее ту же пару атомов углерода как часть своей кольцевой структуры. Дело в том, что влияния, возникающие в результате свободных электрических вращений, оказываются атомами углерода групп СН лишь на одной стороне. Они никоим образом не пересекаются с существованием подобных влияний на другой стороне. Отношения ориентации на второй стороне идентичны отношениям на первой стороне. Ни одно кольцо не может забрать атом водорода и стать радикалом фенила потому, что присутствие другого кольца препятствует приближению свободных атомов водорода. Следовательно, соединение с двумя кольцами обладает высокой степенью устойчивости. Пример такого соединения – нафталин -(CH)4 • C=C • (CH)4 - уплотненный кольцевой ароматический углеводород. В этой работе в формуле соединения двойная линия между двумя атомами углерода - это символ, указывающий на структуру вида уплотненного кольца, у которой кольца связаны в двух положениях, а не в одном как у таких соединений, как бифенил. Этот символ не имеет ничего общего с “двойными связями” электронной теории. Третье кольцо, прибавленное таким же способом, образует антрацин. Дальнейшие линейные прибавления создают такие серии соединений как нафтацин, пентацин и так далее. Но совсем не обязательно, чтобы прибавления делались линейно. Поэтому каждое соединение сопровождается другими соединениями, имеющими тот же состав, но разные структуры. Например, соединения состава нафтацена, состоящие из четырех колец (C18H12), включают хризен, нафтантрацен, 3,4-бензофенантрен и трифенилден. Пирен обладает теми же четырьмя кольцами, но более компактной структурой и составом C16H10. Структурное поведение уплотненных колец, по существу, то же, что у единичных колец бензола. Они объединяются для формирования таких соединений как биантрил и банфтил и действуют как радикалы (нафтил, антрил, фенантрил и так далее). Посредством замещения на водород они присоединяют больше колец, создавая такие соединения как трифенил антрацен. С помощью других отрицательных заместителей, доступных ароматическим кольцам, они формируют огромное разнообразие соединений. В эту категорию входят многие интересные и важные соединения, но у них нет новых структурных характеристик. Поэтому они пребывают вне сферы настоящего обсуждения. Для устойчивости не требуются две группы СН среднего кольца структуры антрацина, и их можно убрать. Полученное соединение – бифенилен -(CH)4 • CC=CC • (CH)4. Структура с одной группой СН в среднем кольце, промежуточная между антрацином и бифениленом, исключается низкой вероятностью непрерывного существования единичной группы СН, но подобное соединение может формироваться помещением группы CH2 в промежуточное положение, поскольку группы CH2 не ограничены пребыванием в парах. Новое соединение – флуорен. Другая группа CH2 в противоположном положении восстанавливает структуру антрацина в циклическом среднем кольце. Такое соединение называется дигидроантрацином. Как уже упоминалось, кольцо даже с одной группой CH2 значительно отклоняется от типичного ароматического поведения, поэтому любое такое кольцо классифицируется как циклические структуры. Но этот эффект ограничивается определенным кольцом, а любые прилегающие ароматические кольца сохраняют ароматический характер. Поэтому такие соединения как флуорен дигидроантрацин должны рассматриваться как комбинация цикло-ароматических структур. Таких соединений очень много, они разнообразны, но принципы комбинирования те же, что и у чисто ароматических соединений, и не нуждаются в повторении. Поскольку циклические соединения менее устойчивы, чем соответствующие ароматические соединения, структуры комбинаций не охватывают такую большую область, как ароматические соединения. Но такая устойчивая структура как нафталин проходит через всю область замещения. Начиная с чисто ароматического соединения, последовательные пары атомов водорода могут прибавляться до образования чисто циклического соединения - декагидронафталина. Уменьшение разнообразия комбинационных структур, за счет ослабления силы сцепления в циклическом кольце по сравнению с ароматическим кольцом, в некоторой степени препятствуют способности групп CH2 формировать кольца разных размеров. Например, 1,2,3,4-тетрадронафталин может терять одну из групп CH2 и формировать индан -(CH)4 • C=C • (CH2)3-. Из-за гибкости группы CH2, циклическое кольцо в этом соединении способно замыкаться, даже если две оставшиеся группы CH2 заменяются СН. Это создает инден -(CH)4 • C=C • (CH)2 • CH2. Полинуклеарные циклические соединения образуются так же, как полинуклеарные и комбинационные структуры, но значительно уступают им в разнообразии. Бифенилу и его продуктам замещения соответствуют дициклопентил, дициклогексил и так далее и их производные; трипентил метан имеет циклический эквивалент трициклогексил метан; циклическим аналогом нафталина является бициклодекан и так далее. Последнее основное подразделение кольцевых соединений – гетероциклическая группа. В нее входят все соединения, у которых любые атомы углерода в циклических или ароматических кольцах замещаются другими элементами. Основная причина выделения этих соединений в особую группу в том, что большинство замещений углерода другими элементами требует валентных изменений того или иного вида, в отличие от замещений водорода, которые обычно не включают валентных модификаций (кроме тех случаев, когда два одновалентных атома водорода заменяются двухвалентным заменителем). Некоторые гетероциклические замещения являются замещениями двух групп; в таких случаях обычная циклическая или ароматическая структура не меняется. Например, начиная с хинона -(CH)2 • CO • (CH)2 • CO- (ароматического соединения углерода) и заменяя две группы СН нейтральными группами NH, мы получаем урацил -NH • CO • NH • CH • CH • CO-. Еще одно парное замещение убирает последние углеводородные группы и создает уразин -NH • CO • NH • NH • CO • NH-. У уже упомянутого сложного циклогексан гексона заменен весь водород, а у боразола BH • NH • BH • NH • BH • NH- убирается весь углерод. Все эти гетероциклические соединения состоят исключительно из двучленных, магнитно-нейтральных групп и, следовательно, обладают структурой бензола - шестью группами, организованными в жесткое ароматическое кольцо. Чаще всего гетероциклический заместитель – это единичный атом или радикал. И для поддержания валентного равновесия такое замещение требует изменения валентности в какой-то другой части кольца. Поэтому замещения часто происходят в виде сбалансированных пар. Например, у пирона -(CH)2 • CO • (CH)2 • O- комбинация СО не является нейтральной группой, а радикалом с валентностью +2, балансирующим валентность (–2) атома кислорода. Радикал CH2, у которого углерод имеет обычную валентность +4, играет ту же роль у пирана -(CH)2 • CH2 • (CH)2 • O-. Замещение двух атомов азота со сбалансированными валентностями +3 и (–3) в ароматическом кольце создает диазин. Если атомы азота находятся в положениях 1,2, соединение называется пиридазин -N•N•(CH)4. Свойства соединений 1,3 и 1,4 достаточно отличаются от свойств пиридазина, поэтому им даются другие названия, соответственно пирамидин и пиразин. Поскольку положительные и отрицательные радикалы в кольце не обладают фиксированными положениями (подобно двум концам цепей), их статус невозможно определить положениями, как мы делали это в формулах цепных соединений. Чтобы формула представляла реальную структуру настолько точно, насколько это возможно, следует разработать подходящий метод определения. В целях настоящего обсуждения это не обязательно и может подождать до дальнейшего изучения. Нижеприведенные схемы пирана и пиридазина типичны для гетероциклических соединений с замещениями одного атома или радикала:
Если равновесие валентности не устанавливается с помощью пары заместителей, необходимо изменение валентности одной из нейтральных групп. Замещенный в кольце единичный атом азота где-то в структуре требует валентности +3, чтобы сбалансировать отрицательную валентность азота. Это легко выполняется посредством сдвига валентности одного из атомов углерода до +4. Тогда реконструированное кольцо состоит из атома азота с валентностью (–3), радикала СН с валентностью +3 и четырех нейтральных групп СН. Такое соединение называется пиридином -(CH)5 • N-. Гидратация может выполняться шаг за шагом, посредством промежуточных соединений, вплоть до соответствующей циклической структуры - пиперидина -(CH2)5 • NH-. Если в ароматическое кольцо вводится кислород или другой отрицательный двухвалентный компонент, необходимое балансирование валентности может достигаться последовательным замещением одной из нейтральных групп СН на радикал CH2, как уже отмечалось в случае пирана. Или требуемого равновесия можно достичь без введения дополнительного водорода, если валентность углерода в двух группах СН повышается до уровня +2 (первичная магнитная валентность), образуя два радикала СН, каждый из которых имеет валентность +1. В кольце, состоящем из шести членов, остается нестабильное нечетное число нейтральных групп СН, но структура обладает достаточной гибкостью для замыкания кольца на базе пяти членов. Стабильность восстанавливается испусканием нейтральной группы. Возникающее соединение называется фураном -(CH)4 • O-, кольцом с пятью членами: одним атомом кислорода, двумя нейтральными группами СН и двумя одновалентными, положительными радикалами СН. Замещение на серу вместо кислорода создает тиофен -(CH)4 • S-, а помещение в то же положение отрицательного радикала MN производит пиррол -(CH)4 • NH-. Каждое соединение типа фурана существует и в циклических дигидро и тетрагидро формах. Паттерн ориентации фурана:
Важная характеристика всех колец класса фурана, состоящих из пяти членов, - равновесие валентности, в котором участвуют три из пяти компонентов, два оставшихся компонента являются нейтральными группами, обеспечивающими способность формирования кольца. У фурана комбинация равновесия C+-O•2-C+. Формирование подобной комбинации с азотом в положительном положении требует, чтобы какой-то элемент или радикал, положительный к азоту, занимал положительное положение, и в гетероциклическом подразделении такую роль обычно берет на себя сам азот. При таких условиях самая вероятная валентность +3, как у гидразина. Тогда две валентности азота, +3 и (–3), пребывают в равновесии, а пятый компонент кольца из пяти членов должен быть нейтральной группой. Поскольку это целостная группа, роль нейтральных групп отводится циклической группе CH2 и нейтральному трио N+3-N-3-CH2°. Результат - соединение изопиразол -N • CH • CH • CH2 • N-. Альтернативная компоновка группы создает изоимидазол -N • CH2 • N • CH • CH-. Разновидность этой структуры сдвигает атом водорода из группы CH2 к положительному азоту, что меняет нейтральную комбинацию на NH+2-N-3-CH+1. На этой основе формируются такие соединения как пиразол -N • (CH)3 • NH- и имидазол -N • CH • NH • CH • CH-. Посредством комбинации с другими кольцами из этих основных гетероциклических видов может образовываться огромное разнообразие уплотненных систем, таких как кумарон (бензофуран), индол (бензопиран), хинолин (бензопиридин) и так далее. И единичные кольца, и уплотненные системы открыты для дальнейшего увеличения с помощью всех обсужденных процессов прибавления и замещения. Этому классу принадлежит значительная часть известных органических соединений. Однако со структурной точки зрения основные принципы, вовлеченные в формирование всех этих соединений, те же, что и освещенные в вышеприведенном обсуждении. На предыдущих страницах мы столкнулись с несколькими видами изомерии – существованием разных соединений с одним и тем же составом. Одни соединения (цианиды и изоцианиды) отличаются только валентностью; другие (прямая цепь и ветвящиеся парафины) отличаются положением нейтральных групп; третьи (альдегиды и кетоны) отличаются распределением атомов составляющих элементов в структурных группах. Большая часть изомеров, которые мы исследовали, является отдельными устойчивыми соединениями. Имеются и другие изомерические системы, у которых две формы вещества так легко преобразовываются друг в друга, что устанавливают равновесие, меняющееся в соответствии с условиями, в которых пребывает соединение. Такая форма изомерии известна как таутомерия. Один из известных примеров таутомерии - “кетоновые” и “энольные” формы определенных веществ. Этилацетоацетат COCH3 • CH2 • CO • (O • CH2 • CH3) - это кетоновая форма соединения, существующего и в энольной форме как этил эфир гидроксикротонной кислоты COH • CHCH3 • CO • (O • CH2 • CH3). Чтобы справиться с изменением физических и химических условий, соединение свободно переходит из одной формы в другую. Это еще один пример изменений валентности для равновесия углерода и водорода и указание на легкость, с которой могут совершаться такие изменения. У радикала COCH3 валентность углерода +4, а весь водород отрицательный. Преобразование в энольную форму включает уменьшение валентности углерода до +2, и для сохранения равновесия один атом водорода сдвигается с (–1) до +1. Тогда группа CH2 в радикале не нужна, и она сдвигается к соседней, нейтральной группе. Оставшаяся часть молекулы не меняется. Развитие СТОВ еще не включает изучение таутомерии. Оно еще не затронуло и те виды таутомерии, которые зависят от геометрической компоновки частей-компонентов молекулы, такие как оптическая таутомерия. Поэтому эти аспекты общей темы молекулярной структуры будут отложены для последующего изучения. Эта глава – последняя из четырех, посвященных исследованию структуры химических соединений. Заканчивая обсуждение, было бы уместно указать, как материал этих глав увязывается с общим планом работы, определенным в главе 2. Традиционное обсуждение молекулярной структуры, которое мы находим в учебниках, начинается с эмпирического наблюдения существования определенных химических соединений - хлорида натрия, бензола, воды, этилового спирта и так далее, обладающих определенными свойствами и разными молекулярными структурами. Затем теоретическая трактовка пытается изобрести правдоподобные объяснения существования наблюдаемых соединений, их структур и других свойств. Настоящая работа полностью дедуктивная. Посредством развития необходимых следствий фундаментальных постулатов СТОВ мы находим, что во Вселенной Движения должна существовать материя. Она должна существовать в форме ряда элементов. Элементы должны обладать способностью (разными способами) сочетаться друг с другом для формирования химических соединений. В этой и предшествующих главах выведены самые важные из теоретически возможных видов молекулярных структур и описаны состав и структура конкретных соединений. Вторая цель этого труда – сравнить теоретические комбинации с наблюдаемыми химическими соединениями. Например, чисто теоретически мы выводим существование соединения в форме цепи, состоящей из трех групп атомов. Первая группа содержит три атома элемента № 1, один атом элемента № 6, результирующая валентность группы +1. Вторая группа имеет два атома элемента № 1, один атом элемента № 6 и нейтральна; то есть, результирующая валентность группы равна нулю. Третья группа состоит из одного атома элемента № 1, одного атома элемента № 8, результирующая валентность группы (–1). Теоретический состав и структура пребывают в полном согласовании с составом наблюдаемого соединения, известного как этиловый спирт, и со структурой этого соединения, полученной в результате физического и химического наблюдения и эксперимента. Следовательно, можно прийти к выводу, что этиловый спирт является химическим соединением, существующим в физической Вселенной, и соответствующим соединению, которое должно существовать в теоретической Вселенной СТОВ. Иными словами, мы определили теоретическое соединение как этиловый спирт. На предшествующих страницах приведено огромное количество подобных согласований. Они недвусмысленны и почти самоочевидны. Это свидетельствует о корректности, как теоретического развития, так и эмпирического определения молекулярных структур. Если имеются расхождения (как в случае со структурой этилена), они легко объяснимы. Поскольку размер и сложность молекул увеличиваются, количество и разнообразие возможных модификаций теоретической структуры тоже увеличиваются, и даже в большей пропорции, а наблюдаемые расхождения уменьшаются. В случае больших молекул согласованность менее определенна, чем в случае небольших простых молекул; но это не значит, что из-за существования более сложных теоретических соединений возникает какая-то дополнительная неопределенность. Это значит, что доступная эмпирическая информация не адекватна для принятия определенного решения о том, какие из наблюдаемых соединений соответствуют определенной теоретической структуре. Поэтому можно ожидать, что дальнейшее исследование прояснит большую часть вопросов. Обсуждение химических соединений завершает описание первичных физических сущностей - актеров в драме физической Вселенной. В томе 2 мы начнем распространение теоретических выводов на исследование самой драмы - деятельности, в которую вовлечены эти сущности. Глава 20. Цепные соединения Ничего, кроме движения Глава 20: Цепные соединения Предпринимая общее исследование такой обширной области, как структура органических соединений, очевидно, важно воспользоваться неким видом системы классификации для группирования соединений с похожими характеристиками так, чтобы избежать необходимости иметь дело со многими отдельными веществами. Различие между цепными и кольцевыми соединениями уже упоминалось. Химические свойства цепных соединений определяются преимущественно природой положительных и отрицательных радикалов или атомов, поэтому для этих соединений удобнее установить две отдельные классификации - одна на основе положительного компонента, вторая на основе отрицательного компонента. По сути, классификация, использованная в этой работе, будет соответствовать обычным группированиям, но определяющие критерии не обязательно будут одинаковыми; и в некоторых случаях это будет приводить к расхождению. Первая (положительная) классификация, которую мы будем рассматривать, включает те соединения, положительные компоненты которых содержат четырехвалентные атомы углерода. Такие соединения называются парафинами. Сначала это название относилось только к углеводородам, но сейчас оно будет распространяться на все цепные соединения четырехвалентного углерода на положительном конце молекулы. Пока нас интересуют цепные соединения, термин “насыщенное соединение” обычно используется, по сути, в том же значении, но такое применение обычно распространяется и на циклические соединения. Во избежание путаницы, он не будет использоваться в этой работе, поскольку на основании установленных нами критериев циклические соединения не могут считаться насыщенными. Парафиновая углеводородная или алкановая цепь – это связь нейтральных групп CH2 с положительным радикалом CH2 на одном конце цепи и отрицательным атомом водорода на другом. Сцепление между атомом водорода и соседней группой CH2 очень сильное, и для большинства целей удобнее рассматривать комбинацию CH2 • H как отрицательный радикал CH3. На этом основании парафиновая углеводородная цепь такова: CH3 • (CH2)n• C3. Если атом двухвалентного углерода заменяется атомом четырехвалентного углерода, получается олефин (алкин) - цепь, идентичная парафину, за исключением того, что в роли положительного компонента она обладает первичным магнитно-валентным радикалом CH вместо обычно-валентного радикала CH3. Общая формула олефиновых углеводородов или алкинов - CH • (CH2)n• CH3. В обычной версии этой формулы одна из групп CH2 пребывает вне группы CH, но это не совместимо со структурными принципами, изложенными на предыдущих страницах. На первый взгляд может показаться, что все говорит в пользу традиционной последовательности CH2 • CH. Если убрать все внутренние, магнитно-нейтральные группы, мы приходим к CH • CH3 - теоретической структуре этилена, первого из олефинов, хотя обычно принято считать, что химическое поведение этого соединения пребывает в большей гармонии со структурой CH2 • CH2. Это мнимое противоречие объясняется природой отрицательного радикала CH3. Как уже указывалось, на самом деле этот радикал является CH2 • H. В принципе эту комбинацию можно рассматривать как одну единицу, но если формулу этилена выразить в развернутой форме - CH • CH2 • H, можно видеть, что связь между структурными единицами CH и H теснее, чем между CH2 и H. Да, если молекула этилена цела, группа CH2 находится между CH и H, CH и H являются партнерами в валентном равновесии, а промежуточная группа CH2 нейтральна. Но если молекула достаточно потревожена химическими или другими средствами, единицы СН и Н объединяются, и соединение вступает в последующую реакцию как две молекулы метилена (CH2). Это не такая уж необычная ситуация. Многие наблюдатели сообщали, что при таких обстоятельствах реагирующая молекула не обязательно та же, что молекула в нетронутом состоянии. Одновалентный атом углерода в роли положительного компонента создает ацетилен. По определению, в класс олефина и ацетилена следует включить все соединения с отмеченными положительными компонентами, а не просто углеводороды. Ныне принятые молекулярные формулы олефинов и ацетиленов должны быть пересмотрены так, чтобы поместить положительно-валентный компонент в конец цепи. Также мы находим, что одновалентная ориентация одиночного атома углерода более устойчива, если он присоединяется к нейтральной группе, у которой углерод имеет ту же валентность, а не к той, у которой валентность углерода равна +2. Независимый атом углерода, составляющий положительный компонент ацетиленов, следует за нейтральной группой CH. Остаток молекулы ацетиленового углеводорода или алкина идентичен соответствующей части молекулы любой из двух других углеводородных цепей, и общая формула представляет собой C • CH • (CH2)n• CH3. Ацетилен похож на этилен тем, что его истинная структура - C • CH • H2, с валентным равновесием между единичными атомами С и Н. Это вынуждает их соединяться, если молекула распадается. Следовательно, химически, соединение действует как две единицы СН. Прибавление нейтральной группы CH2 к прямой цепи углеводородов не обязательно происходит в существующей цепи. Вместо этого, входящие группы могут вставляться между положительными и отрицательными компонентами любой из нейтральных групп, расширяя группу с СН до CH • CH2 • H2, которую, как установлено раньше, мы можем записать как CH • CH3 или CHCH3. Дальнейшие прибавления могут осуществляться так же, как это делается в основной цепи, - независимым удлинением нейтральной группы. Удлиненная группа известна как ветвь основной цепи, а структуры такого типа называются соединениями с разветвленной цепью. Разветвление радикала CH3 невозможно, поскольку прибавление группы CH2 создает CH2 • CH2 • H2 или CH2 • CH3, просто удлиняя прямую цепь. Однако группу CH2 можно прибавить к радикалу олефина СН. В этом случае результатом будет CCH3, не эквивалентный расширению цепи. Затем группу CCH3 можно удлинить обычным способом до C • CH2 • CH3 и так далее. В общепринятых системах терминологии соединения с разветвленной цепью именуются производными соединений с прямой цепью, а положение в цепи указывается числом. Например, 2-метил бутан, 2,3-диметил гексан, и так далее. Дополнительная возможность модификации положительного радикала в олефинах вносит дополнительные вариации в систему, что принимается в расчет с помощью установления нескольких основных классификаций: 1-олефины, 2-олефины, 3-олефины и так далее. Разветвление трактуется так же, как и у парафинов, а соединения получают такие названия как 2-этил-1-гексин, 3,4-диметил-2-пентин и так далее. На основании структурных связей, установленных в этой работе, названия парафинов в нынешней системе одинаково применимы и к этим соединениям. Однако современные идеи о структуре олефинов и ацетиленов и связанная с ними система терминологии - это результаты электронной теории образования соединений. Результаты СТОВ говорят о необходимости определенной модификации ранее принятых структурных компоновок и изменения названий некоторых соединений. На новой основе олефинам не требуется никакая особая система названий, поскольку система парафинов может распространяться и на олефины. Единственная разница между ними состоит в разветвлении радикала олефина. С этим можно справится, применяя термин 1-алкил, имеющийся, но не употребляющийся в парафиновых соединениях. На этом основании 1-пентин CH • (CH2)3 • CH3, станет просто пентином, 2-пентин CCH3 • (CH2)2 • CH3 становится 1-метил бутаном, а 3-пентин (C • CH2 • CH3) • CH2 • CH3 становится 1-этил пропаном. Тем же способом названия парафинов можно применить к ацетиленам. 1-пентин, C • CH • (CH2)2 • CH3 становится пентином; 2-пентин C • CCH3 • CH2 • CH3 становится 2-метил бутаном и так далее. Пересмотр терминологии желателен не только с точки зрения более точного отражения истинной структуры молекул и не только ради единообразия, он позволяет значительное упрощение. Информация, полученная в теории, потребует и некоторой модификации традиционных методов представления молекулярной структуры органических соединений. Следует отказаться от так называемых “расширенных формул”, основанных на концепциях электронов и двойных связей (которым, как свидетельствуют наши выводы, нет места в молекуле). По существу точное расположение индивидуальных атомов незначимо. Структурная единица – это скорее группа, чем атом, а положения групп определяются природой и величиной свойств соединения, зависящих от структуры. Поэтому в большинстве обычных случаев адекватно обозначение, которое использовалось до сих пор, - “сжатые” структурные формулы, показывающие лишь состав и последовательность групп. Обычная компоновка сжатых формул не совсем удовлетворительна, поскольку не указывает на существование положительных и отрицательных валентностей, и, следовательно, не проводит различия между группами одного и того же состава, но противоположной валентности. Например, СН - конечная группа в молекуле парафина - рассматривается всегда одинаковой. Поскольку противоположные валентности играют очень важную роль в молекулярной структуре, желательно, чтобы формула определенно указывала на положительный и отрицательный компоненты соединения. Этого можно достичь без какого-либо серьезного нарушения знакомых паттернов посредством определения положительных и отрицательных компонентов в целом соответственно на правом и левом концах формулы, что является обычной практикой в неорганическом подразделении. Хотя бы в целях связности было бы логично распространить такую политику на индивидуальные компоненты молекул, и когда-нибудь это должно быть сделано. Представляется, в настоящей работе был бы полезен компромисс между логикой и связностью, чтобы избежать дальнейшего усложнения для читателей, которым уже пришлось бороться с неизбежными отступлениями от традиционной практики. Поэтому для таких первичных единиц как NH2 и OH, а также для таких расширений как NH • CH2 • CH3, O • CH2 • CH3 и так далее знакомые выражения будут сохранены, хотя у большинства отрицательных радикалов это переворачивает обычный положительный порядок на отрицательный. Использование CH3, а не CH2 • H для представления отрицательных метиловых радикалов – тоже отступление от практики связности. Но в этом случае сжатая форма не только более знакома, но и более удобна. Таким образом, полное представление CH2 • H будет использоваться только тогда, когда при обсуждении структуры молекулы этилена необходимо акцентировать истинную природу радикала. В случае отрицательного радикала, аналогичного CH2, использование сжатого выражения не дает значимого преимущества. И этот радикал – комбинация нейтральной группы СН и отрицательного атома водорода – будет показан в его истинной форме - CH • H. В целях правильного представления молекулярной структуры, очень важно четкое определение нейтральных групп. Если имеются замещения метила, определение может осуществляться пропуском границы деления между компонентами нейтральной группы; например, CH3 • CHCH3 • CH2 • CHCH3 • CH3, 2,4-диметил пентан. Более длинные нейтральные группы можно определить скобками, тогда внутри группы сохраняется положительно-отрицательный порядок. На этом основании формула 3-пропил пентана будет такой: CH3 • CH2 • (CH • CH2 • CH2 • CH3) • CH2 • CH3. Если внутри нейтральных групп потребуется дальнейшее подразделение, разницу между главными группами и подгруппами можно обозначить скобками или другими подходящими символами. Если включаются два отрицательных компонента, а цепь двойная, подходит привычное выражение (CH3 • CH2)2 • O, если цепи одинаковые. Не одинаковые цепи можно представить выделением двухвалентного компонента и одной из ветвей как отрицательного радикала: CH2 • CH2 • CH2 • (O • CH2 • CH3), или две ветви могут быть показаны на отдельных строчках:
Чтобы представить новые принципы молекулярной структуры, разработанные на основе постулатов СТОВ, в этой работе будут использоваться пересмотренные структурные формулы, описанные в предыдущих параграфах. Для определения положений в цепи мы будем пользоваться нумерацией с положительного конца, а не следовать женевской системе, рассматривающей два конца как взаимозаменяемые. В свете сделанных модификаций разная нумерация необходима для прояснения не только порядка групп, но, в некоторых случаях, и состава группы. Однако пересмотренная нумерация будет использоваться лишь в целях обсуждения; во избежание ненужной путаницы будут сохранены принятые названия соединений. Раньше или позже потребуется полный пересмотр органической номенклатуры. Небольшие модификации нынешних, структурных идей, требующиеся для олефинов и ацетиленов, обретут большую значимость для диолефинов. Диолефины – это класс соединений, у которых в олефиновую цепь вставляется пара нейтральных групп СН с одновалентным ацетилен углеродом, то есть двухвалентная структура. Соединения C5 этого класса известны как пентадиены. Если группы CH2 заменяются группами CH в третьем и четвертом положениях пентина, результат - CH • CH2 • CH • CH • CH3. Вместо использования системы нумерации, относящейся к другим членам семьи углеводородов, диолефины нумеруются в соответствии с положениями гипотетических “двойных связей”; такое соединение называется 1,3-пентадиен. Поскольку группа CH3 на отрицательном конце молекулы пентина на самом деле является CH2 • H2, часть CH2 открыта замене на СН. Таким образом, входящие группы СН могут занимать четвертое и пятое положения, создавая соединение CH • CH2 • CH2 • CH • CH • H2, которое сейчас называется 1,4-пентадиен. Другая возможная структура включает удаление атома водорода из положительного радикала СН и расщепление молекулы на две цепи. Если цепи одинаковы, имеется соединение C(CH•CH3H2), которое можно представить и в виде:
Это 2,3-пентадиен. Разновидность этой структуры удаляет группу CH2 из одной из комбинаций CH3. Это низводит соединение до статуса С4, но его можно восстановить до пентадиена путем вставления группы CH2 в другую ветвь. Это создает то, что называется 1,2-пентадиеном:
С промышленной точки зрения самым важным из диолефинов является изопрен - другое соединение C5, сейчас называемое 2-метил-1,3-бутадиен. Его структура такая же, как у 1,4-пентадиена, за исключением того, что группа CH2, следующая за первой из нейтральных групп СН, убирается из цепи и присоединяется к группе СН как ветвь: CH • CH2 • CCH3 • CH • H. Азот, стоящий за углеродом в атомных сериях, - следующий самый плодовитый элемент в образовании соединений. Некоторые из “углеродных” соединений, такие как мочевина (одно из первых синтезированных органических соединений), на самом деле, содержат больше азота, чем углерода, но положительным компонентом в этих соединениях является углерод. Удлинение цепи достигается преимущественно путем прибавления групп углерода. Однако имеются и другие соединения, в которых азот играет положительную роль в соединении в целом и в нейтральных группах. Углеводородам соответствуют гидроазоты. У этих соединений положительным радикалом азота является NH2+, в котором азот обладает усиленной нейтральной валентностью 3. Комбинация этого радикала с отрицательной аминной группой дает гидразин NH2 • NH2. Вставляя одну нейтральную группу NH, мы получаем триазан, NH2 • NH • NH2. Еще одно аналогичное прибавление дает тетразан, NH2 • NH • NH • NH2. Как далеко может заходить этот процесс неясно, поскольку теоретические пределы не установлены, а гидроазоты изучены не так исчерпывающе, как соответствующие соединения углеводородов. В качестве положительного компонента азотные серии, соответствующие ацетиленам, обладают единичным атомом азота с вторичной магнитной валентностью 1. Родительское соединение этой серии – диимид, N • NH2. Прибавление одной нейтральной группы NH дает триазен, N • NH • NH2. С помощью еще одного прибавления мы получаем тетразен, N • NH • NH • NH2. И вновь, дальнейшее удлинение цепи неясно. В этих азотных соединениях все нейтральные группы имеют набор NH2, у которого азот обладает вторичной магнитной валентностью 1. Теоретически возможна нейтральная группа NH2, основанная на первичной магнитной валентности, но эта группа похожа на радикал амина, за исключением ориентации вращения; ориентация подвергается изменению в соответствии с относительными вероятностями. Радикал амина – более вероятная структура, она препятствует существованию нейтральной группы NH2. Радикал NH2+ - тоже намного менее вероятная структура, чем радикал амина, у которого азот обладает нормальной отрицательной валентностью, но этот положительный радикал не соперничает с группой амина. Если поблизости имеются единицы NH2, межатомные силы способствуют соединению, и чтобы соединение имело место, некоторые группы должны переориентироваться так, чтобы действовать как положительные компоненты соединений. Радикал NH2+ обладает самыми вероятными положительными ориентациями и берет на себя положительную роль в NH2 • NH2 и подобных комбинациях; положение закрытое для радикала амина. Нейтральная группа NH2 не обладает таким защищенным статусом. Выше углерода и азота способность образовывать соединения молекулярного типа резко падает, но соответствующие элементы более высоких групп участвуют в нескольких соединениях такой природы. Кремний образует серии гидридов, аналогичных парафиновым углеводородам, с составом SiH3 • (SiH2)n • H, а также несколько соединений, промежуточных между кремниевыми и углеводородными цепями. Типичными примерами последних являются Si3 • CH2 • SiH2 • H, и Si(CH3)3 • CH2 • SiH2 • CH2 • SiH2 • H. Германий образует серии гидридов, известных как германы, они похожи на гидриды кремния или силаны и обладают составом Ge3 • (GeH2)n • H. Известны лишь несколько членов этих серий. Также сообщалось о неустойчивом гидриде олова Sn3 • SnH2 • H2. Следовало ожидать, что три элемента с более высокой валентностью образовывали бы ограниченное число соединений, подобных гидроазотам; и известные соединения такого вида все еще редки. Сообщалось о дифосфене PH2 • PH2 и какодиле As(CH3)2 • As(CH3)2. Поскольку минимальная магнитная валентность фосфора и мышьяка равна 2, эти соединения не могут иметь гидразиновую структуру NH2 • NH • H2, и, возможно, являются соединениями PH • PH2 • H и AsCH3 • As(CH3)2 • CH3. Как указывалось в связи с этиленом и ацетиленом, химическое поведение таких соединений объясняется тенденцией положительного и отрицательного компонентов соединения в целом (таких как PH и Н в дифосфене) объединяться, если соединение нарушается во время химической реакции. Другие серии соединений молекулярного класса, не относящиеся ни к углероду, ни к азоту, основаны на боре. Поскольку в двумерных соединениях бор действует как элемент Деления IV, он принимает валентность 5, а не обычную валентность 3, которой обладает в соединении, таком как B2O3, где выступает в роли элемента Деления I. Одновалентный радикал на основе валентности 5 был бы BH4 или его эквивалентом, но такой радикал был бы трехмерным и не способным к объединению в двумерную цепь. Следовательно, положительным радикалом в цепи бора является двухвалентная комбинация B3. Как и в углеводородах, отрицательным компонентом молекулы в целом является водород, поэтому требуются два отрицательных атома водорода с валентностью положительного радикала. И вновь, как и в углеводородах, имеется тесная связь между атомами водорода и соседней, нейтральной группой BH, а комбинацию можно рассматривать как отрицательный радикал B3 с валентностью 2. Однако для нынешних целей представляется полезным показывать его в истинной форме - BH • H2. Магнитные, нейтральные группы соединений бора могут формироваться на основе либо первичной, либо вторичной магнитной валентности, что дает соответственно BH2 и BH. Поскольку это сводит к минимуму число атомов водорода на отрицательном конце молекулы, отрицательный радикал BH • H2 обретает преимущество над BH2 • H2, даже если промежуточные группы являются комбинациями BH2. Присутствие нейтральной группы ВН на отрицательном конце соединения, наряду с некоторыми другими факторами, благоприятствующими преимуществу ВН над BH2, делают структуры ВН более устойчивыми, чем те, в которых нейтральными группами являются BH2. Основным гидридом бора является диборан B3 • BH • H2. Прибавление нейтральных групп ВН создает серии соединений с составом B3 • (BH)n • H2. Самыми известными из них являются гексаборан, у которого n = 5, и декаборан, у которого n = 9. Замена двух групп BH на пару групп BH2 выливается в серии, обладающие составом B3 • (BH2)2 • (BH)n • H2. Как указывалось в предыдущем параграфе, выше тетраборана, первого члена этих серий (n = 1), соединения менее устойчивы, чем соответствующие соединения всех серий ВН. Во всех соединениях бора замена атомов водорода одновалентными атомами или радикалами возможна так же, как и в углеводородах, но в намного более ограниченной степени. Как уже отмечалось, распространение характеристик Деления IV на Деление III, способствующее возникновению двумерных комбинаций бора, не относится к соответствующим элементам более высоких групп в любой значимой степени, и они не дублируют серии соединений бора. Имеется неустойчивый гидрид алюминия Al2H6 и соединение Ga2H6, называемое дигаленом. Оба соединения могут быть структурно похожими на диборан, но с небольшим удлинением соединений посредством магнитных, нейтральных групп. С химической точки зрения молекулярные соединения, образованные элементами, кроме углерода, не так уж интересны, поэтому в любых специализированных учебниках им уделяется лишь небольшое внимание, если уделяется вообще. Однако они важны для нас, поскольку служат подтверждением теоретических выводов, сделанных в связи со структурой углеродных соединений. Соединения азота и бора не только строятся в соответствии с общим, выведенным из теории паттерном и следуют соединениям углерода (то есть, цепи магнитных, нейтральных групп с положительным радикалом на одном конце и отрицательным радикалом на другом), но и подкрепляют теоретические выводы в связи со структурными деталями. Они похожи на углеводородные соединения в тех отношениях, в каких теория находит их похожими, и отличаются от углеводородов в тех отношениях, в каких имеются теоретические различия. Например, все три элемента образуют двухвалентные (CH2 и так далее) и одновалентные (СН и так далее) магнитные, нейтральные группы (за исключением NH2, отсутствие которого объяснялось) потому, что эти магнитные валентности являются свойствами группы элементов (2А), которой принадлежат все три элемента. С другой стороны, радикалы в конечных положениях не одинаковы потому, что электрические валентности, связанные с этими радикалами и обуславливающие свойства каждого из трех элементов, разные. Вторая система классификации органических цепных соединений, основанная на природе отрицательных компонентов, является не альтернативой, а параллельной системой. Соединение классифицировалось как спирт потому, что природа его отрицательного компонента принадлежит одной из категорий, установленных на основе идентификации положительного компонента. Для упрощения представления предшествующее обсуждение в основном сосредотачивалось на углеводородах, но все утверждения, сделанные в связи с соединениями, у которых отрицательным компонентом является водород (один или в соединении с CH2, и с отрицательным радикалом CH3), одинаково справедливы и для тех соединений, у которых водород заменен эквивалентным, отрицательным атомом или группой. Поэтому у нас есть парафиновые спирты, олефиновые спирты (ненасыщенные) и так далее. Первостепенное требование для замен один к одному таково: валентность заменителя должна соответствовать валентности водорода, как по величине, так и по знаку. Этим требованием пренебрегают современные структурные теории, не осознающие существования положительной и отрицательной валентности в органических соединениях. У этих соединений одни атомы водорода положительные, другие отрицательные, и это определяет, какие замены могут иметь место. Водород в комбинации с углеродом отрицательный и может заменяться любыми галогенами или отрицательными радикалами. Водород в комбинации с кислородом положительный и, следовательно, может заменяться только положительными элементами и радикалами. Поэтому из уксусной кислоты CH3 • CO • OH посредством замены CH2Cl • CO • OH мы получаем хлорацетиловую кислоту, а не CH3 • CO • ONa, или ацетат натрия Na • (O • CO • CH3). Действуя в одиночку, атом водорода может быть либо положительным, либо отрицательным в зависимости от внешнего окружения. На конце углеводородной цепи атом водорода отрицателен и может заменяться галогеном. Этан CH3 • CH2 • H становится этил хлоридом CH3 • CH2 • Cl. При формировании кислоты H • CO • OH атом водорода положителен и не может замещаться галогеном. Щелочные элементы нормальной валентности тоже не могут заменить одновалентный, магнитный атом водорода, и входящий положительный атом отходит к радикалу ОН. В комбинациях N-H водород тоже устойчив к одноатомным замещениям, но легко поддается замещению радикалами подходящей валентности. В положительных и отрицательных радикалах элементы с более высокими валентностями довольно свободно замещаются либо углеродом, либо водородом, но входят в магнитные, нейтральные группы в основном как составляющие общих одновалентных радикалов - OH, NH2 и так далее. За исключением прямой комбинации углерод-кислород - СО, обязательным компонентом расширенного радикала, такого как (O • CH2 • CH3), является единичный двух или трехвалентный атом в нейтральной группе. Начиная обсуждение главных семейств замещенных соединений, мы будем рассматривать спирты. Классификация спиртов основывается на результатах разных способов прибавления кислорода к углеводородам. Радикал ОН непосредственно примыкает к углеводородной группе, заменяя отрицательный атом водорода. Однако то, что группа ОН заменяет определенный атом, представляющий отрицательный компонент соединения в целом, не существенно. Химическое поведение обычных спиртов, у которых радикал ОН находится на конце цепи, как в этиловом спирте CH3 • CH2 • OH, почти такое же, как если ОН заменяется атомом водорода в одной из нейтральных групп, как у вторичного бутилового спирта CH3 • CH2 • CHOH • CH3. Если замещение имеет место в положительном радикале, результат немного другой. Такое замещение намного вероятнее, если сначала кислород помещается на более благоприятный отрицательный конец соединения. Продуктом двойного замещения ОН является двухосновной спирт или гликоль. Самое известное соединение – этилен гликоль, CH2OH • CH2 • OH. Ранее в этой главе отмечалось, что на самом деле парафиновые углеводороды не являются такими симметричными структурами, какими кажутся. На каждом конце молекулы имеется комбинация одного атома углерода и трех атомов водорода, но один конец цепи обязательно положительный. Это значит, что на этом конце цепи группа CH3 является радикалом, у которого углерод обладает валентностью +4, а другой конец цепи обязательно отрицательный. Как уже объяснялось, это значит: группа CH3 в этом положении является закрытой связью отрицательного атома водорода с нейтральной группой CH2, у которой углерод обладает валентностью +2. Если важна истинная молекулярная структура, скажем для понимания химического поведения этилена, существенно осознать, что CH3 в нейтральном положении, на самом деле, представляет собой CH2 • H. Как указывалось в формуле, приведенной для этилен гликоля, та же асимметрия присутствует и в других соединениях, кажущихся симметричными. В положительном положении в гликолях группа CH2OH обладает углеродом с валентностью +4 и валентностью группы в целом +1. В отрицательном положении валентность углерода +2, а истинная структура выглядит как CH2 • OH. Учебники по химии содержат такие утверждение, как: “Теоретически, самым простым гликолем должен быть дигидрокси метан, CH2(OH)2“. Объяснение структуры гликоля показывает, почему это соединение не было бы гликолем, и почему оно не обнаружено. Прибавленный к углеводороду атом кислорода может заменяться двумя атомами водорода нейтральной группы CH2, а не образовывать радикал ОН. Получившаяся группа СО почти не может действовать как магнитная, нейтральная группа, поскольку сильно ограничена своим положением в молекуле. Прямые цепи групп СО, похожие на цепи CH2, не возможны. Это объясняет, почему окись углерода существует как отдельное соединение, а метилен нет. Чтобы группа СО могла присоединяться к органической комбинации, требуется помощь со стороны геометрической компоновки (положение, которое будет обсуждаться позже в связи с исследованием кольцевых соединений). У цепных соединений это легче осуществить на отрицательном конце молекулы. Следовательно, при обычной компоновке единичная, нейтральная группа СО присоединяется непосредственно к отрицательному атому или радикалу. Если отрицательный компонент является радикалом ОН, получившееся соединение содержит комбинацию CO • OH и является кислотой. Уксусная кислота CH3 • CO • OH и акриловая кислота CH • CH2 • CO • OH - представители соответственно парафиновых и олефиновых (ненасыщенных) кислот. И вновь, сдвиг валентности углерода до +4 создает положительный радикал того же состава и позволяет образование двухосновных кислот, таких как щавелевая кислота COOH • CO • OH, малеиновая кислота COOH • CH • CH • CO • OH, и так далее. Модификация структуры кислоты посредством замещения алкиловой группы на гидроокись водорода приводит к другому семейству соединений – эфирам. Типичными представителями моно и ди эфиров являются соответственно этил ацетат CH3 • CO • (O • CH2 • CH3) и диэтил оксалат CO(O • CH2 • CH3) • CO • (O • CH2 • CH3). Подобное замещение у спирта создает эфир. Эфир можно рассматривать как радикал состава O • (CH2)n • CH3 в комбинации с группой алкила. Если сейчас мы заменим второй такой же радикал на один из атомов водорода в соседней углеводородной группе, то получим ацеталь. Еще одна подобная замена даст ортоэфир. Например, последующими замещениями в этиловом спирте CH3 • CH2 • OH мы получаем метил этил эфир CH3 • CH2 • (O • CH3), диметил ацетил CH3 • CH • (O • CH3)2 и триметил ортоацетат CH3 • C • (O • CH3)3. Удаление молекулы воды из двух молекул кислоты создает ангидрид, например, уксусный ангидрид (CH3 • CO)2 • O. В эти соединения не включаются никакие новые структурные характеристики. Если нейтральная группа СО присоединяется непосредственно к отрицательному атому водорода на конце углеводородной цепи, получается соединение альдегид. Самый известный член этого семейства - ацетальдегид CH3 • CO • H. Альдегидный радикал обычно выражается как СНО (как говорят учебники, чтобы не путать с радикалом ОН), но это не отражает истинного статуса комбинации СО как нейтральной группы. Ничего не стоит заметить, что представление СНО не объясняет (как это делает формула CO • H), почему одна из самых важных характеристик альдегидов - они хорошие восстановители. Подобно другим обсужденным органическим семействам альдегиды формируют двухосновные и одноосновные соединения. Самым простым двухосновным альдегидом является глиоксал COH • CO • H. Как и в таких структурах как COOH • CO • OH, преобразование отрицательного радикала в положительный включает сдвиг валентности. Но у кислот изменению подвергается валентность углерода, от +2 в CO • OH до +4 в СООН, а у альдегидов - валентность водорода, от -1 в CO • H до +1 в СОН. Это самые основные изменения валентности в органических реакциях, и их побочные влияния являются существенным элементом в широком разнообразии химических реакций. Например, в дополнительных реакциях, переводящих олефиновые соединения в статус парафинов (например, дополнение HBr до акриловой кислоты), валентность углерода в положительном радикале увеличивается на две единицы: от +2 до +4. Одновременно атом водорода, обладавший валентностью +1 у HBr, уменьшает свою валентность на две единицы до уровня –1 в конечном продукте CH2Br • CH2 • CO • OH. Способу изменения валентности нет преград. Это просто вопрос переориентации - изменение направления вращения; и каждый атом свободен переориентироваться так, чтобы соответствовать своему окружению. Но у соединения должно сохраняться равновесие “положительный - отрицательный”. Изменение от положительного к отрицательному и наоборот у атома водорода является одним из самых известных способов компенсации увеличения или уменьшения валентности углерода. У углеводородов из-за тесной связи между отрицательным атомом водорода и соседней группой CH2 нейтральная группа СО может занимать положение рядом с комбинацией CH2 • H как альтернатива положению альдегида рядом с атомом водорода. В этом более удаленном положении она находится поблизости от предела стабильности, и это делает связь с положительным радикалом вероятнее, чем участие в отрицательной комбинации CO • CH2 • H. По этой причине одноосновные соединения этого семейства – кетоны - имеют кислород в положительном радикале COCH3, а не в отрицательном радикале как обычно. Первый член семейства - диметил кетон или ацетон - обладает структурой COCH3 • CH2 • H. Соответствующее двухосновное соединение – диметил дикетон COCH3 • CO • CH2 • H. Одноосновную кетоновую структуру можно выверить с помощью сравнения результатов простых реакций прибавления кетонов к альдегидам, изометрических соединений, в которых группа СО нейтральна. Прибавление водорода к альдегидам продолжается следующим образом: CH3 • CH2 • CO • H + H2 = CH3 • CH2 • CH2 • OH Конечный продукт - пропиловый спирт, - это обычное цепное соединение с радикалом CH3 в положительном положении, как и в самом альдегиде. Изменен лишь отрицательный конец молекулы. Если бы группа СО в соответствующем кетоне (метил этил кетоне или 2-бутаноне) обладала тем же статусом, что и в альдегиде (то есть, если соединение было бы CH3 • CH2 • CO • CH3), следовало ожидать того же результата. Мы бы ожидали, что положительный радикал CH3 останется пассивным, а первичным или, возможно, вторичным продуктом будет спирт. Но поскольку группа СО у кетона является частью радикала, у которого валентность углерода равна 4, а соединение, на самом деле, представляет собой COCH3 • CH2 • CH3, обе группы CH3 отрицательные. Прибавление атома водорода к нейтральной группе CH2 создает третью отрицательную группу CH3. Ввиду отсутствия положительного радикала СН, гидрогенизация выливается в третичный спирт, в котором группы CH3 отрицательные, как и в исходном кетоне: COCH3•CH2•CH3 + H2 = C(CH3)3•OH У обсужденных цепных органических соединений удлинение цепи достигается в основном за счет прибавления нейтральных групп CH2, и в некоторых случаях пар CH • CH. Введение кислорода создает нейтральную группу СНОН, и замещение CH2 на эту группу создает дополнительные семейства соединений. Они включают такие важные вещества как оксикислоты, полиоксиспирты и сахариды. Оксикислоты могут быть либо одноосновными, как молочные кислоты CH3 • CHOH • CO • OH, либо двуосновными, как виннокаменная кислота COOH • (CHOH)2 • CO • OH. В обоих случаях цепи можно расширить прибавлением большего числа групп СНОН, хотя возможно и прибавление CH2, как в яблочной кислоте COOH • CHOH • CH2 • CO • OH. Полиоксиспирты - это расширения гликолевой цепи нейтральными группами СНОН. Общая формула - CH2OH • (CHOH)n• CH2 • OH. Сахариды появляются в результате преобразования радикалов CH3 (в альдегидах и кетонах) в CH2OH и прибавления нейтральных групп СНОН. Продукты, полученные из альдегидов, - альдозы, общая формула которых CH2OH • (CHOH)n • CO • H. Продукты, полученные из кетонов, - кетозы, их структура (CO • CH2 • OH) • (CHOH)n • CH2 • OH. Если в альдегид или кетон вводится азот, заменяя комбинацию углерод-кислород на тройную комбинацию азота, водорода и кислорода в форме двухвалентного оксирадикала NH • O, природа дополнительных продуктов демонстрирует то же отношение к структурам двух оксопроизводных, какое мы замечали в случае прибавления водорода. Прибавление NH к альдегиду изменяет только отрицательный радикал, который расширяется от CO • H до CH • NH • O. Например, пропион альдегид CH3 • CH2 • CO • H становится окси пропион альдегидом CH3 • CH2 • (CH • NH • O). С другой стороны, прибавление NH к кетонам требует молекулярного перегруппирования для введения отрицательных групп CH3 в комбинацию с положительным углеродом в положительном радикале. Прибавление NH к ацетону COCH3 • CH3 создает диметил кетоксим C(CH3)2 • NH • O. Как указывается в этих формулах, чтобы показать истинный состав, необходимо изменить выражение для оксирадикала с традиционного NOH на NH • O. Другой способ введения азота в углеводороды – замена отрицательного водорода на аминогруппы NH2. Тогда дальнейшие, возможные замещения на положительные атомы водорода в NH2 создают огромное разнообразие структур. Соединения, у которых радикал NH2 остается бездействующим, - это первичные амины; соединения с NH и одним положительным замещением – это вторичные амины, а соединения, у которых заменены оба атома водорода, оставляя от изначальной аминогруппы только один атом азота, - третичные амины. Поскольку замещения амина положительные, эти соединения могут иметь больше одной олефиновой ветви, как у диалиламине (CH • CH2 • CH2)2 • NH, - виде структуры, не обнаруженной у углеводородов, у которых все атомы водорода отрицательные и могут заменяться только отрицательными заменителями. Диамины обладают обычной двойной структурой с CH2NH2 в положительном положении и обычной комбинации амина CH2 • NH2 на отрицательном конце молекулы. Подобно гидроксильной группе ОН, присоединяющейся к СН для формирования нейтральной группы СНОН, аминная группа объединяется с СН для образования нейтральной группы CHNH2. Из-за положения в цепях эта группа более ограничена, чем СНОН, которая легко заменяется на CH2. Но она очень важна как существенный компонент аминокислот, которые, в свою очередь, являются основными строительными блоками белков – базовыми составляющими живой материи. У монокислот действующая группа CHNH2 расширяет кислотный радикал с CO • OH до CHNH2 • CO • OH. Дальнейшее удлинение цепи происходит за счет прибавления углеводородных, нейтральных групп или CНОН, а не CHNH2. Так даланин CH3 • CHNH2 • CO • OH удлиняется до 1-лейцина CH3 • CHCH3 • CH2 • CHNH2 • CO • OH. Эти два соединения являются членами одной подгруппы аминокислот, в которой положительным радикалом является CH3. Вторая подгруппа использует радикал карбоксила СООН в положительном положении. Самое простое соединение этого типа – д-аспарагиновая кислота COOH • CH2 • CHNH2 • CO • OH. Третья подгруппа - д-аминосиклоты - имеет радикалы амина как в положительном, так и в отрицательном положениях., как в д-лизине CH2NH2 • (CH2)3 • CHNH2 • CO • OH. Еще одна комбинация, содержащая азот, - радикал цианид или нитрил. У обычного радикала CN азот имеет валентность (-3), а углерод – первичную магнитную валентность 2; результирующая валентность группы (-1). У радикала NC2, у которого азот имеет усиленную нейтральную валентность 3, положительные и отрицательные роли переворачиваются. При такой ориентации азот обладает свойствами элементов Деления III и положителен к углероду, а не отрицателен как обычно. Поскольку отрицательная валентность углерода равна 4, результирующая валентность радикала NC составляет (–1), идентично валентности CN. Поэтому соединения CN – изоцианиды - обладают тем же составом, что и цианиды, но разными свойствами. В таких соединениях радикал СН+ появляется как цианоуксусная кислота CN • CH2 • CO • OH. Здесь азот отрицательный, как и в радикале CN•, а углерод обладает обычной положительной валентностью 4; поэтому результирующая валентность группы +1. Цианоген CN • CN, - это комбинация радикалов +1 и –1. Соединения с комбинацией CO • CN в отрицательном положении обычно не рассматриваются как отдельное семейство и именуются как обычные цианиды. Приведение нейтральной группы СО в соединение с NH2 создает амид - структуру открытую необычайно широкому разнообразию прибавлений и замещений. Начиная с ацетамида (амида уксусной кислоты) CH3 • CO • NH2, можно обычным способом прибавлять группы CH2 для образования пропионамида CH3 • CH2 • CO • NH2 и более высоких гомологов. Или можно заменять положительные радикалы амино водородом и получать такие соединения как N-этил ацетамин CH3 • CO • (NH • CH2 • CH3). Комбинация NH, обладающая результирующей валентностью (–2), может занимать место кислорода в амидной группе CO, образуя нейтральную группу CNH, обладающую похожими свойствами. Такое замещение в ацетамиде дает ацетамидин CH3 • CNH • NH2. Если нейтральная группа СО в ацетамиде заменяется положительным радикалом СО, мы получаем аминоацетон COCH3 • CH2 • NH2. Дальнейшее замещение углерода азотом изменяет радикал COCH3 на CONH2 и создает абсолютно новые серии - мочевину CONH2 • NH2 и ее производные. Еще одна группа СО превращает одноосновный карбамид (мочевину) в двуосновное соединение оксамид CONH2 • CO • NH2. Отрицательная комбинация кислорода и азота, которой можно заменить водород, - нитрогруппа NO2. Такая замена выливается в семейство, известное как нитропарафины. Типичным представителем этого семейства является 1-нитропропан CH3 • (CH2)2 • NO2. У нитропарафинов группа NO – это комбинация положительного азота (валентность +3) и отрицательного кислорода (-2 каждый). Изомерное семейство соединений - алкил нитриты - включает группу ONO, у которой один атом кислорода с усиленной нейтральной валентностью +4 и атом азота с обычной валентностью (–3) образуют одновалентный, положительный радикал ON. Дальнейшая комбинация с отрицательным кислородом создает одновалентный, отрицательный радикал ONO. В обычных условиях (CO • CO) комбинация CO • NO2 пребывает вне магнитных, нейтральных пределов, и нет серий соединений CO • NO2, соответствующих сериям, основанным на CO•NH2. У соединений четвертичного аммония азот обладает нейтральной валентностью 5, как у неорганических нитратов, и соединяется с эквивалентом пятивалентных, отрицательных атомов или радикалов для формирования соединений, начиная с простых комбинаций, таких как гидроксид тетраметиламмония N(CH3)4 • OH, и кончая очень сложными и биологически важными соединениями, такими как лецитин. Четвертичная часть аммония в молекуле лецитина N(CH3)3OH • CH2• CH2• OH существует и отдельно, так же как хлор. Прибавление кислорода к радикалам цианида и изоцианида создает радикалы OCN и ONC, образующие основу цианатов и изоцианатов. Сравнение цианидов и цианатов хорошо иллюстрирует способ, которым разные уместные факторы входят в строительство химических соединений. Каждый элемент обладает несколькими возможными ориентациями вращения, которые он может принимать для формирования химических соединений. В каждой ориентации он обладает действующим смещением скорости или валентностью, определяющей статус элемента в соединении и отношение, в котором он сочетается с другими компонентами. Одни ориентации вероятнее, чем другие, но вид самой устойчивой комбинации не может определяться преимущественно на основе вероятности, поскольку в ситуацию входят и другие факторы. Один из факторов – ограничение на прямые комбинации из-за относительной отрицательности составляющих. Другой фактор – относительно большая вероятность групп с низкими валентностями в радикалах. Значимым фактором является и способность к замещению. Одновалентный радикал – не только более вероятная структура, чем радикал с более высокими валентностями. Он обладает способностью свободного замещения атомов водорода, а радикалы с более высокой валентностью выполняют замещения лишь с определенным трудом. Следовательно, в окружении, благоприятном для замещений (если он может сформироваться), одновалентный радикал обладает преимуществом. В любом конкретном примере, если имеются два или более возможных способа строительства одновалентного радикала, именно общее влияние всех действующих факторов определяет, какая из возможных комбинаций обладает наибольшей вероятностью и, соответственно, наибольшей устойчивостью. При надлежащих условиях, если преимущество одной структуры над другой невелико, могут существовать обе структуры. Но если преимущество велико, может существовать только более устойчивое соединение. У цианидов общий итог всех факторов, влияющих на комбинацию углерода и азота, благоприятствует углероду с валентностью +2 и азоту с валентностью (–3). Альтернатива с углеродом (–4) и азотом +3 достаточно закрыта, чтобы быть устойчивой. Если к любому радикалу прибавляется кислород с валентностью (–2), положительная валентность должна увеличиться на две единицы так, чтобы результат обладал одновалентной заменой для отрицательного водорода. Это возможно в обоих случаях, поскольку и углерод и азот обладают требующимися более высокими валентностями. Углерод движется из первичной магнитной валентности +2 в CN в обычную валентность +4 в OCN. Азот движется из усиленной нейтральной валентности +3 в NC в нейтральную валентность +5 в ONC. Отрицательные валентности не меняются: азот обладает валентностью (–3) в CN и OCN, углерод – валентностью (–4) в NC и ONC. Участие элементов групп с более высокими вращениями в химических соединениях не включает новых структурных характеристик. В группах с более высоким вращением за счет таких факторов, как более высокие магнитные валентности, большие межатомные расстояния и преимущество распределений трехмерных сил, элементы исключаются из многих видов комбинаций и структур, в которых участвуют элементы Группы 2А. Но в той степени, в какой они могут занимать положения в комбинациях и структурах, они делают это на той же основе, что и аналогичные элементы Группы 2А. Следовательно, описания разных видов комбинаций и структур, описанных на предыдущих страницах, относятся и к соединениям элементов более высоких групп, а также к особо упомянутым элементам. Сера больше всего подходит к дублированию структур более низкой группы. Соответствующий элемент группы 2А – кислород - почти целиком пользуется ее отрицательной валентностью. И в той степени, в какой позволяют межатомные расстояния, сера, обладающая валентностью (–2), дублирует соединения кислорода. В соответствии со спиртами, кислотами, эфирами, амидами и так далее, которые обсуждались на предыдущих страницах, имеются тиаспирты, тиакислоты, тиаэфиры, тиаамиды и так далее. Они идентичны за исключением того, что кислород заменяется серой. Межатомное расстояние C-S больше, чем расстояние С-О. Поэтому соединения серы менее устойчивы, чем их кислородные аналоги, что довольно сильно ограничивает общее количество таких соединений. Значимое положение здесь таково: расстояние C-S не позволяет формирование нейтральных групп CS и замену нейтрального СО на CS. Это устраняет вероятность наличия семейств соединений серы, аналогичных семействам кислорода, чьими отрицательными радикалами являются CO • OH, CO • NH2, CO • OCH3 и так далее. Имеются тиакислоты, но их радикал не CS • OH или CS • SH, а CO • SH. Хотя представляется, что формула соединения, записанная в соответствии с нынешней практикой, указывает на присутствие группы CS в нейтральном положении, на самом деле, это двухвалентная комбинация, образующая часть положительного радикала. Таким образом, тиаацетамид и тиамочевина, обычно представленные в виде CH3 • CS • NH2 и NH2 • CS • NH2, на самом деле являются CSCH3 • NH2 и CSNH2 • NH2. Ни CSOH, ни CSSH не исключают действия в качестве одновалентного, положительного радикала - положения, в котором межатомное расстояние не является контролирующим фактором, но оба они ограничены в стабильности. CSOH имеет тенденцию переорганизовываться в более вероятную форму COSH2, а CSSH чувствителен к потере молекулы CS. Например, ксантиковая кислота CSSH • (O • CH2 • CH3) спонтанно делится на CS и этиловый спирт. Еще один пример смещения валентностей путем прибавления сильно отрицательного элемента – окисление сульфидов. У сульфида метила (CH3)2S сера обладает обычной валентностью (–2). Вследствие того, что она положительна к кислороду, окисление помещает ее в положительное положение в соединении с валентностью +4 и группами CH3, способными совершать сдвиг +1 или –1 в сторону отрицательности. Результат - метил сульфоксид SO(CH2 • H)2. Дополнительный атом кислорода получается за счет дальнейшего сдвига валентности серы до максимальной величины +6 (нейтральная валентность). Новое соединение – метил сульфон SO(CH2 • H)2. Радикалы единичных элементов, такие как N3(N+5 • N-3 • N-3) и C2(C+2• C•-4), следуют тому же паттерну поведения, что и другие радикалы. Эти конкретные комбинации образуют соответственно азиды и карбиды. Поскольку карбиды не содержат никаких элементов кроме углерода и водорода, они относятся к семейству углеводородов, хотя со структурной точки зрения введение радикала C2 в обычный углеводород эквивалентно замещению любым другим радикалом. Поэтому, логически, возникающие соединения должны называться карбидами. Карбидная структура очевидна у таких соединений как (CH • CH2)2 • C2. Эта структура называется дивинилацетилен или 1,5 гексадиен-3-ин. Здесь валентное равновесие такое же, как у бинарных карбидов: CaC2 и так далее. Однако, как указывалось раньше, соображения вероятности благоприятствуют одновалентным радикалам везде, где они возможны. У углеводородов комбинация C2 обычно объединяется с положительным атомом водорода для образования одновалентного радикала C2H, структурно аналогичного ОН. Соединениями, пользующимися этим радикалом, могут быть либо олефины (например, винилацетилен CH • CH2 • C2H), либо ацетилены (например, бутадиен C • CH • C2H). Магнитно-нейтральные группы могут прибавляться обычным способом, образуя такие соединения как 1,5 гексадиен C • CH • CH2 • CH2 • C2H. Это соединение известно и как дипропаргил - изомер бензола. Оно привлекало большое внимание в начале появления структурной химии, когда “проблема бензола” находилась в центре внимания. Самый первый результат действия воды на карбид кальция - простой карбид H • C2H. Поскольку водород отрицателен к углероду, соединение углерода и положительного водорода неустойчиво, и карбидо-водород стразу же меняется на ацетилен, у которого атомы водорода отрицательные. В этих сериях реакций очень интересны изменения валентности. У первичного карбида кальция валентности таковы: Ca +2, C+2, C-4. Реакция с водой заменяет два +1 атома водорода на кальций. Затем относительная отрицательность углерода и водорода помещает водород в отрицательное положение, и, поскольку общая отрицательная валентность составляет лишь две единицы, для достижения равновесия углерод вынужден принимать валентность +1. Хотя у органических соединений трехмерные неорганические радикалы типа SO4 не способны свободно заменяться водородом по способу органических радикалов, органические цепи могут заменять атомы, присоединяющиеся к трехмерным радикалам в неорганических соединениях. Иными словами, в двумерной структуре нет места трехмерному компоненту, но двумерная комбинация может занимать положение в трехмерной структуре. Типичными соединениями являются этил сульфат (CH3 • CH2)2 • SO4 и метил фосфат (CH3)3 • PO4. Соединения металлов с органическими радикалами обычно группируются в отдельную категорию - металлоорганические соединения. В этой работе они классифицируются как органические потому, что обладают обычной органической структурой. Соединение этил натрия Na • CH2 • CH3, обладает той же структурой, что и соответствующий углеводород парафина - пропан CH3 • CH2 • CH3. Соединение дифенил олова обладает той же структурой, что и дифенил метан – одно из ароматических кольцевых соединений, которые мы будем обсуждать в главе 21. Следовательно, при обсуждении молекулярной структуры, не требуется отдельного рассмотрения ни металлоорганических соединений, ни соединений органических и неорганических компонентов. Количество и разнообразие цепных соединений может значительно увеличиваться за счет дополнительного ветвления посредством комбинирования разных уже обсужденных заместителей и использования некоторых менее обычных заместителей. Все соединения следуют структурным принципам, выведенным для самых обычных органических цепных семейств. Структурные изменения могут происходить и с помощью некоторых дополнительных способов. Поэтому было бы желательно дополнить молекулярную картину некоторыми комментариями. Но поскольку комментарии одинаково относятся и к кольцевым соединениям, уместно отложить их обсуждение до тех пор, пока мы не исследуем кольцевые структуры. Глава 19. Сложные соединения Ничего, кроме движения Глава 19: Сложные соединения Обсуждение в предыдущей главе относится только к соединениям типа RmXn, в которых m положительных атомов соединяются с n отрицательных атомов. Но разработанный принцип распространяется на все комбинациям атомов. Наша следующая задача – распространение этих принципов на исследование некоторых более сложных ситуаций. Каждый атом каждого простого соединения можно заменить другим атомом с той же валентностью и номером. Следовательно, любой или все четыре атома хлора в CCl4 можно заменить эквивалентными, отрицательными атомами, создавая целое семейство таких соединений, как CCl3Br, CCl2F2, CClI3, CF4, и так далее. Или можно заменить n одновалентных атомов хлора на атом с отрицательной валентностью n, получая такие соединения как COCl2, COS, CSTe и так далее. Аналогичные замены можно сделать и в положительном компоненте, создавая такие соединения как SnCl4. Однако простая замена на атом с другой валентностью невозможна. Например, медь обладает той же числовой валентностью, что и натрий, но атомы натрия в соединении Na2O не меняются на атомы меди. Имеется соединение Cu2O, но нейтральная структура валентности этого соединения очень отличается от структуры нормальной валентности Na2O. Аналогично, если мы заменяем атом положительного водорода (магнитная валентность) на один из атомов натрия (нормальная валентность) в соединении Na2O, этот процесс не является простой заменой. Вместо NaHO мы получаем NaOH - соединение абсолютно другого характера. Фактор, играющий важную роль в строительстве сложных молекулярных структур, таков: существование основных различий в величинах сил вращения в разных межатомных комбинациях. Например, давайте рассмотрим соединение KCN. В этом соединении азот – отрицательный элемент, а положительно-отрицательные комбинации – это K-N и C-N. Подсчитывая межатомные расстояния (с помощью отношений, которые будут обсуждаться позже), мы обнаруживаем, что величины в естественных единицах составляют 0,904 для R-N и 0,483 для C-N. Как установлено в главе 18, термин “связь” не используется в этой работе и никоим образом не связан с темой этой главы – “могущество” соединения или валентность. Термин “валентная связь” или любое производное типа “ковалентная связь” не имеет места в теоретической структуре СТОВ. Однако употребление слова “связь” удобно при описании сцепления между конкретными атомами и группами атомов; поэтому в последующем обсуждении оно будет использоваться в этом ограниченном смысле. На этом основании можно сказать, что сила сцепления или “прочность связи” значительно больше у C-N, чем у K-N, поскольку она определяется разницей в межатомных расстояниях. Обычно считалось, что сила сцепления указывает на прочность межатомных сил, но, на самом деле, отношение обратное. Как объяснялось в главе 8, гравитационные силы, влияющие на атомы (силы, возникающие в результате вращения атома), - это силы отталкивания в области времени. Поэтому чем слабее гравитационные силы, тем сильнее сцепление. В рассматриваемой комбинации короткое расстояние C-N и соответствующая прочность связи - результат наличия измерений с недействующей силой. Это ослабляет действующую силу отталкивания и требует более тесного сближения атомов для установления равновесия с постоянной силой последовательности системы отсчета. Вследствие большей силы, во многих процессах, разрушающих или модифицирующих связь K-N, связь C-N остается незатронутой, и общее поведение соединения KCN – это скорее поведение комбинации K-CN, чем группы независимых атомов, таких, как у соединения K2O. Группы подобные CN, обладающие относительно высокими величинами сил связи и способные сохранять свое своеобразие, даже если в соединениях, в которых они существуют, происходят изменения, называются радикалами. Поскольку особые свойства радикалов обуславливаются различиями между силами сцепления самих радикалов и силами других связей в соединениях, степень, с какой любая конкретная группа атомов действует как радикал, зависит от величины этих различий. Если межатомные силы очень слабые, связь, соответственно, очень сильная, как в комбинации C-N. Радикал сильно сопротивляется разделению и во многих отношениях действует как единичный атом. Другая крайность: если различия между разными межатомными связями в молекуле невелики, пограничная черта между радикалами и не радикальными группировками атомов неуловима. Более сильными радикалами являются определенные структурные группы. NH4 структурно равнозначна атому натрия. В кристалле CdI2 OH можно заменить на I без изменения структуры, и так далее. Самые слабые радикалы - радикалы с самыми маленькими границами силы сцепления - кристаллизуются в структуры, у которых радикал как таковой роли не играет, а структурные единицы являются индивидуальными атомами. Известный пример – структура перовскит (CaTiO3). Здесь каждый атом структурно независим. Отсюда такой вид компоновки пригоден для соединения, подобного KMgF3, в котором определенно отсутствуют радикалы, и для соединения, подобного KIO3, содержащего пограничную группу. С точки зрения структуры группа IO3 в соединении KIO3 не является радикалом, хотя действует как радикал в некоторых других физических явлениях и обычно осознается как таковая. Например, с температурной точки зрения, при низких температурах группа IO3 – определенно радикал, и вся группа действует как единица. Но в отличие от сильных радикалов, таких как OH и CN, сохраняющих статус единицы при всех обычных условиях, при высоких температурах IO3 распадается на две температурные единицы – другие радикальные группы, еще менее устойчивые к изменениям температуры. Например, группа CrO3 действует как одна температурная единица при низких температурах, но в верхней части температурного диапазона твердых тел все четыре атома не зависят от температуры. Температурное поведение химических соединений, включая упомянутые примеры, будет обсуждаться в следующем томе. Чтобы занимать место единичных атомов в трехмерных неорганических структурах, радикалы должны обладать силой, распределенной на все три измерения. В случаях, когда некоторые межатомные силы двумерны, что справедливо для более низкой группы элементов по причинам, которые будут объясняться позже, трехмерное распределение достигается посредством геометрической компоновки. Поэтому типичные неорганические радикалы состоят из группы атомов-спутников, трехмерно сгруппированных вокруг одного или более центральных атомов. Ввиду того, что атомы-спутники находятся между центральным атомом и противоположным компонентом соединения, действующая валентность радикала может иметь тот же знак, что и атомы-спутники. Ограничение в связи с результирующей валентностью означает, что большинство неорганических радикалов - отрицательные. Водород – единственный элемент, обладающий распределением силы в двух измерениях, если выступает в роли положительного компонента. Самый важный радикал этого класса – аммоний NH4, у которого водород обладает магнитной валентностью 1, азот – отрицательной валентностью 3, а общая валентность группы +1. Радикал фосфония аналогичный, но менее распространенный. Разновидностью NH4 является радикал тетраметил аммония N(CH3)4, у которого атомы водорода заменяются положительными группами CH3. Теоретически возможное количество отрицательных радикалов очень велико, но влияние соображений вероятности сводит количество реально существующих радикалов до небольшой величины по сравнению с отрицательными радикалами, которые могли бы быть построены теоретически. При всех прочих одинаковых условиях самыми вероятными являются группы с самым маленьким результирующим смещением. Поэтому обычно мы обнаруживаем BO2-1, менее часто BO3-3, а не BO4-5, BO5-7 или другие высокие числа этих серий. В ситуацию входят и геометрические соображения. При тождественности других характеристик, самыми вероятными комбинациями будут те, у которых силы размещаются самым симметричным образом. На основании разработанных до сих пор критериев статус бинарных радикалов, таких как OH, SH и CN, неоднозначен, поскольку отсутствует различие между центральными атомами и атомами-спутниками. Но эти группы могут включать неорганические радикалы, потому что способны входить в трехмерные неорганические, радикальные компоновки. Еще один особый класс радикалов сочетает положительные и отрицательные валентности одного и того же элемента. Имеется азидный радикал N3, у которого атом азота с нейтральной валентностью +5 сочетается с двумя отрицательными атомами азота с валентностью –3 каждый; общая валентность группы (-1). Аналогично, атом углерода с первичной магнитной валентностью +2 соединяется с отрицательным атомом углерода с валентностью (-4), образуя карбидный радикал C2 с валентностью (-2). Распространенными радикалами боридов - комбинациями структур бора, упомянутыми в главе 18, являются B2, B4 и B6. Самые известные соединения B4 - это прямые комбинации элементов Деления I с валентностью 4. Поэтому можно прийти к выводу, что результирующая валентность комбинации B4 составляет (-4). Роль B6 в таких соединениях как CaB6 и BaB6, указывает на то, что итоговая валентность радикала B6 составляет (-2). Статус радикала B2 определен не так ясно, но представляется, что он тоже имеет валентность (-2); то есть, половину комбинации B4. Результирующая валентность (-2) может создаваться либо комбинацией отрицательной валентности (-3) с вторичной магнитной валентностью +1, либо комбинацией отрицательной валентности (-5) с положительной валентностью +3. Эти же две альтернативы имеются и для B4. Комбинация валентностей +1 и (-3) возможна и для радикала B6. На основании этих величин валентности всех боридных радикалов представляют последовательную систему, представленную на нижеприведенной таблице:
Однако радикал B6 не может создаваться комбинацией валентностей +3 и –5. И чтобы воспользоваться валентностью –5 необходимо ввести положительный компонент с валентностью +2. Отрицательная валентность –3 ведет к более согласованному набору комбинаций и увязывается с валентностью бора в прямых комбинациях бора с положительными элементами. По крайней мере, сейчас можно прийти к выводу, что имеющиеся свидетельства говорят в пользу отрицательной валентности бора (–3). Общие принципы сложного образования, разработанные для простых комбинаций, распространяются и на соединения, содержащие радикалы неорганического класса. Основное требование таково: валентность радикальной группы должна пребывать в равновесии с равной и противоположной валентностью. Поэтому для формирования соединения K2SO4 отрицательный радикал SO4 соединяется с необходимым количеством положительных атомов. Аналогично, положительный радикал NH4 соединяется с отрицательным атомом для создания соединения NH4Cl. Или как в соединении (NH4)2SO4 радикалами могут быть оба компонента. Еще один новый фактор, появляющийся при группировании, - относительная отрицательность атомов внутри группы больше не имеет никакого значения. Например, азидная группа N3 отрицательная, и не может быть никакой другой, кроме как отрицательной. Тогда в соединении ClN3 атом хлора обязательно положительный, хотя в прямых комбинациях Деления IV, таких как NCl3, атом хлора отрицательный к азоту. В соединениях с магнитной валентностью отрицательное электрическое смещение пребывает в равновесии с одним из магнитных смещений положительного компонента. Это избавляет положительное электрическое смещение от прямого направляющего влияния на другие молекулы или атомы. В общих аспектах направляющее влияние похоже на ориентирующее влияние равновесия пространства-времени, которое требуется для того, чтобы атомы отрицательных элементов вступали в соединения с другими атомами. В обоих случаях имеются определенные относительные положения взаимодействующих атомов или молекул, позволяющие более тесное сближение, что выливается в большую силу сцепления. Ни один из факторов ориентации ничего не вносит в силу сцепления; факторы ориентации просто удерживают участников в положениях, в которых создаются более мощные силы. Без ограничений направления, налагаемых ориентирующими влияниями, относительные положения были бы случайными, и не создавалась бы более мощные силы сцепления. Поскольку соединения с магнитной валентностью обладают свободными электрическими смещениями, все они тяготеют к соединению, образуя то, что мы можем назвать молекулярными соединениями; то есть соединениями, в которых составляющими являются молекулы, а не индивидуальные атомы или радикалы соединений атомов. Ввиду того, что все свободные электрические смещения положительные, равновесие валентности не включается, и молекулярные соединения могут носить почти любой характер. Но соображения геометрии и симметрии благоприятствуют связям единиц одного вида или близких единиц. Двойные молекулы соединения не всегда распознаются в твердых или жидких состояниях, но, несмотря на трудность распознавания, имеется много хорошо известных комбинаций, таких как FeO, Fe2O3, C2O, CO и так далее. Вода и аммиак - соединения магнитной валентности - особенно гибки в формировании комбинаций такого вида. Они соединяются с великим множеством веществ с целью формирования гидроокисей и аминатов. В любой бинарной комбинации с магнитной валентностью имеется лишь одно свободное электрическое смещение. Поэтому ориентирующее влияние действует только в одном направлении. Если активные влияния молекулярной ориентации (как мы будем их называть) пары молекул, таких как FeO and Fe2O3, направлены друг к другу, система закрыта, и возникающее соединение Fe3O4 не обладает никакими дальнейшими тенденциями к соединению. Даже если несколько молекул H2O комбинируются с той же базовой молекулой, что происходит очень часто, связь между базовой молекулой и каждой молекулой H2O индивидуальна. Если на основе магнитной валентности формируется двумерная молекула, создается совсем другая ситуация. Здесь межмолекулярное расстояние может уменьшаться до положения, в котором три молекулы находятся внутри одной естественной единицы пространства. В этом случае каждая молекула оказывает ориентирующее влияние не только на ближайшую соседку по действующему направлению, но и на следующую удаленную молекулу. В этом классе соединений ограничение действующих межатомных сил двумя измерениями вносит свой вклад в расширение влияний магнитной ориентации двумя разными способами. Первый: оно уменьшает межатомное расстояние на треть, поскольку в третьем измерении отсутствует действующая сила вращения. Например, в соединении лития хлора расстояние между литием и атомами хлора на трехмерной основе было бы 1,321 естественных единиц. По причине двумерной ориентации оно уменьшается до 0,881 единиц. Тогда расстояние между молекулами 1 и 3 уменьшается еще больше из-за геометрического эффекта, показанного на Рис. 3. В совокупности, в которой структурные единицы организованы трехмерно, как в графе (а), молекула 2 размещает весь свой диаметр между молекулами 1 и 3. Если межатомное расстояние принять за x, тогда расстояние между центрами молекул 1 и 3 составляет 4x. Но если структурные единицы организованы двумерно, как в графе (b), расстояние уменьшается до 2y, если y – это расстояние между соседними, центральными атомами. Рисунок 3(а) (b)
В случае лития хлора такого уменьшения недостаточно для того, чтобы позволить любое взаимодействие между молекулами 1 и 3, поскольку расстояние 2y составляет 1,398. Если расстояние превышает единицу, не оказывается никакого влияния. Но имеются и другие соединения, особенно соединения углерода и азота, в которых расстояние 2y может быть равным или меньше единицы. Например, расстояние С-С пребывает в диапазоне от 0,406 до 0,528. В случае больших расстояний, посредством геометрического расположения большое количество соединений углерода, основанных на магнитной ориентации, оказывается внутри области, в которой ориентирующие влияния свободного электрического смещения распространяются на третью молекулу. Молекулы с двумерной магнитной валентностью и очень короткими межатомными расстояниями - это реально устойчивые структуры. Их отрицательные электрические вращения полностью уравновешиваются надлежащими положительными магнитными вращениями. Поэтому, как и другие молекулы, которые мы рассматривали, они способны существовать независимо. Однако из-за сильных тенденций к соединению, если имеются другие молекулы, с которыми они могут комбинироваться, большая часть таких молекул обладает лишь моментальным сроком независимой жизни. В знак признания того, что обычно они, скорее составляющие молекулярных соединений, чем просто молекулы, мы будем относить их к магнитно-нейтральным группам. Поскольку имеется много соединений атомов с межатомным расстоянием меньше половины естественной единицы или настолько близким к этой цифре, что их можно увязать с ней путем структурных модификаций, количество комбинаций, способных формировать магнитно-нейтральные группы, ограничивается разными факторами, такими как вероятность, валентность, относительная отрицательность и так далее. Комбинации CN и OH исключаются, поскольку обладают активными валентностями; то есть, являются отрицательными радикалами, а не нейтральными группами. NH2 исключается вероятностью ситуации, которая будет обсуждаться позже; OH2 исключается потому. что водород сильно положителен к кислороду и так далее. Кроме того, бинарные валентности двух комбинаций подвергаются дополнительному ограничению. Его истинная природа еще не ясна, но влияние выражается в помещении CO в предел стабильности, поэтому, такие комбинации как NO и CS тоже исключаются. Практическое влияние этих ограничений, наряду с ограничениями межатомного расстояния, заключается в сведении магнитно-нейтральных групп, за исключением CO, к комбинациям углерода, азота и бора с одновалентными атомами или радикалами. В последующем обсуждении удобнее пользоваться схемой, определяющей влияния ориентации, которые приводят к разным структурным единицам. Также она показывает, как разные виды молекулярных соединений удерживаются в соединениях; то есть, положениях, в которых межгрупповые силы сцепления максимальны. На схеме мы будем представлять влияния валентности двойными линиями, как в CH3=OH, а влияние первичной молекулярной ориентации – единичными линиями, как в CH-CH. Вторичные молекулярные влияния, оказываемые на третью группу в цепи, будут изображаться связующими линиями, со стрелками, указывающими направление влияния ориентации.
Как указывает схема, между группами СН 1 и 2 и группами СН 3 и 4 имеется влияние первичной ориентации. Поскольку эти влияния не направленные и не спаренные; между группами 2 и 3 взаимодействие отсутствует. Если группы CH были бы трехмерными, как молекулы FeO и Fe2O3, упомянутые выше, тогда между парой 1-2 и парой 3-4 не было бы соединения, и в результате были бы две молекулы CH-CH. Но поскольку группа 3 пребывает внутри одной единицы расстояния группы 1, ориентирующее влияние свободного электрического смещения группы 1, действующее вблизи группы 2, дистанционно распространяется и на группу 3, как показано на схеме. Аналогично, влияние 4-3 дистанционно распространяется на группу 2. Поэтому пары 1-2 и 3-4 удерживаются в соединении посредством влияний вторичной ориентации, несмотря на отсутствие первичного влияния между группами 2 и 3. Отношение ориентирующих влияний к сцеплению между составляющими атомного или молекулярного соединения можно сравнить с влиянием пониженной температуры на насыщенную жидкость. Результат понижения температуры – затвердение; и в твердых телах между атомами имеется дополнительная сила сцепления, которой не существовало в жидкости. Но новая сила не создается температурой. На самом деле, изменение температуры создает необходимые условия, при которых атомы способны обретать относительные положения, в которых работают межатомные силы сцепления. Аналогично, ориентирующие влияния равновесия валентности и свободного смещения вращения магнитно-нейтральных групп не создают сил, удерживающих молекулы вместе; они создают лишь условия, позволяющие действие более интенсивных сил сцепления. Если атомы или нейтральные группы подвергаются действию ориентирующих влияний, позволяющих установить равновесие в одном из коротких межатомных или межгрупповых расстояний, величина сил сцепления определяется именно точкой равновесия между силами вращения и противоположно направленной силой, возникающей за счет естественной системы отсчета. Важным следствием является то, что сила сцепления между любыми двумя определенными магнитно-нейтральными группами одна и та же, невзирая на то, является ли ориентация результатом первичного действия вблизи, или вторичного действия на длинном расстоянии свободных электрических смещений. На вышеприведенной схеме величина силы сцепления между группами 2 и 3 идентична силам сцепления между группами 1-2 и 3-4. Это сила сцепления между двумя группами CH. Как мы увидим позже, особенно в главе 21, это положение значимо в связи с попытками сделать выводы, касающиеся молекулярной структуры, на основе величин межгрупповых сил. Как указывают стрелки схемы на двух концах комбинации из четырех групп, вторичные ориентирующие влияния не достаточны, они способны распространяться лишь на любой другой атом или группу, находящиеся внутри зоны влияния. Следовательно, такое соединение нейтральных групп открыто для дальнейшего комбинирования в обоих направлениях. Система не закрыта для прибавления других групп того же характера, поскольку оставляет активное вторичное ориентирующее влияние на каждом конце комбинированной структуры. Уникальная способность к соединению, возникающая в результате распространения вторичных влияний, создает крайне обширное и сложное разнообразие химических соединений. Ограничений на количество групп, способных соединяться, почти не существует. До тех пор, пока каждый конец молекулы является магнитно-нейтральной группой с действующим вторичным влиянием, имеются два активных конца, не взирая на то, сколько прибавляется групп. Формирования соединения без дальнейших тенденций к объединению можно достичь одним из двух способов. Может соединяться достаточное количество магнитно-нейтральных групп, чтобы позволить концам цепи закругляться и соединяться, удовлетворяя несбалансированные вторичные влияния и создавая кольцевое соединение. Или, альтернативно, последние группы могут присоединяться к атомам или радикалам, не обладающим ориентирующими влияниями магнитных групп. Такие прибавления закрывают систему и образуют цепное соединение. Цепные и кольцевые структуры известны как органические соединения. Это название возникло в самом начале появления химии, когда считали, что естественные продукты состоят из природных веществ, абсолютно отличающихся от составляющих неорганической материи. Как он используется здесь, термин “органический” будет относиться ко всем соединениям с характерной двумерной структурой магнитной валентности, а не определять, как обычно, только соединения углерода (с некоторыми исключениями). Практически, исключенные углеродные соединения – это одни и те же соединения, подходящие под оба определения. Единственная, значимая разница между ними в том, что в органическую классификацию включены несколько дополнительных соединений, таких как гидроазоты, обладающих тем же видом структуры, что и органические углеродные соединения. В цепных соединениях должно поддерживаться валентное равновесие, и прибавление положительного радикала или атома на одном конце цепи должно быть сбалансировано прибавлением отрицательной единицы с той же валентностью на другом конце. В связи с кольцевыми соединениями вопрос равновесия не возникает, поскольку все структурные единицы в кольце – это либо магнитно-нейтральные группы, либо нейтральные объединения атомов или групп с активными валентностями. В этом случае полное равновесие валентности достигается внутри групп или объединений. Чтобы присоединить двумерную магнитную группу, структуры любых радикалов, которые должны занимать положения на концах, тоже должны быть двумерными. Для этого не подходят трехмерные неорганические радикалы, такие как NO3, SO4 и так далее. В неорганических соединениях двухатомные и трехатомные радикалы, такие как OH, CN и NO2, организованы трехмерно, но не обязательно ограничены таким видом соединения. Они могут организовываться и двумерно. Следовательно, эти радикалы доступны и для двумерных соединений. Двумерная структура переворачивает требование в связи с результирующей валентностью радикалов. Внешние контакты двумерных групп обеспечиваются преимущественно центральными атомами; и вместо того, чтобы иметь то же направление, что и атомы-спутники, результирующая валентность соответствует валентности центрального атома. Следовательно, эти группы - органические радикалы - противоположны по валентности своим дубликатам среди неорганических радикалов. Положительному радикалу аммония NH4 соответствует отрицательный радикал амина NH2. Отрицательный радикал CN-, у которого углерод обладает магнитной валентностью 2, имеет органический аналог – положительный радикал CN+, у которого углерод обладает обычной валентностью 4, и так далее. Кроме того, комбинации углерода с одновалентными, отрицательными элементами (включая водород), двумерными и, следовательно, не действующими как неорганические радикалы, полностью совместимы с двумерными, нейтральными группами. Поскольку таких комбинаций много, структурами этого типа является огромное множество органических радикалов. Из вышесказанного ясно, что органические соединения подчиняются тем же валентным условиям, что и неорганические соединения. Фактически, они являются соединениями атомов той же природы. Единственная разница между ними в том, что очень короткие межатомные расстояния в магнитных валентных соединениях более низкой группы элементов позволяют существование вторичных влияний ориентации, что способствует объединению в сложные структуры. Такая унификация целой сферы химических соединений – пример упрощения, возможного тогда, когда выясняется истинная причина физического явления. Как мы видели в главе 18, образование химических соединений происходит потому, что атомы чисто электроотрицательных элементов (Деление IV) не могут устанавливать устойчивую связь с атомами других элементов, кроме как при особых условиях, при которых их отрицательное смещение (движение во времени) уравновешивается надлежащим положительным смещением элементов, с которыми они взаимодействуют. Эти требования распространяются на углерод и другие, более низкие элементы как составляющие неорганических соединений. Все химические соединения управляются одними и теми же общими принципами. Бесспорно, прояснение природы органических соединений потребует модификации современных химических идей. Следует отказаться от концепции электронного происхождения сил сцепления. Электроны – это независимые физические сущности. Они не являются составляющими атомов, и не пригодны для создания сил сцепления, даже если бы могли это делать. (Следует заметить, что вышесказанное не означает, что в атомах нет электронов. Это абсолютно другая проблема, которая будет рассматриваться тогда, когда мы будем готовы начать обсуждение электрических явлений.) Следует отказаться и от концепций “двойных или тройных связей”, наряду с занятной идеей “резонанса”, когда допускается, что система, промежуточная между двумя возможными состояниями, обретает добавочный энергетический компонент за счет изменения. Некоторые теоретические концепции (такие как “двойные связи”), несостоятельные в свете новых выводов, были достаточно полезны на практике. По этой причине химикам будет трудно принять ошибочность этих идей. Как объяснялось во введении, большие успехи, достигнутые в области науки, были сделаны с помощью теорий, сейчас признанных неверными и отброшенных. Причина в том, что ни одна из этих теорий не была полностью неверной. Чтобы обрести любую значимую степень признания, теория должна быть корректна, по крайней мере, в некоторых отношениях. И как продемонстрировал опыт во многих случаях, правомочные характеристики могут внести свой вклад в понимание связанных с ними явлений, даже если другие части теории абсолютно некорректны. Необходимость расставания с давно лелеемыми идеями будет менее болезненной, если осознается, что “двойные связи” и связанные с ними концепции, от которых следует отказаться, не являются реальными физическими сущностями. Это изобретения, с помощью которых определенные эмпирические отношения математической природы облечены в описательный язык для более удобного манипулирования. Линус Полинг выражает это очень ясно в следующих утверждениях: “Структурные элементы, которые используются в классической, структурной теории - единичная связь углерод-углерод, двойная связь углерод-углерод, связь углерод-водород и так далее - тоже являются идеализациями, не существующими в реальности. Да, после продолжительного опыта использования классической, структурной теории химики стали говорить и, возможно, думать о двойной связи углерод-углерод и других структурных единицах теории так, как будто они реальны. Однако размышление вынуждает осознать, что они нереальны, а являются такими же теоретическими конструкциями, как и индивидуальные структуры Кекуле для бензола”.68 Когда появляется корректная теория, она должна включать обоснованные характеристики предыдущей некорректной теории. Но суть таких характеристик, если они появляются в контексте других теорий, часто затемняется тем, что они выражаются другим языком. В рассматриваемом случае современная химическая теория гласит, что сцепление в органических соединениях возникает благодаря электронным силам. СТОВ приводит к выводу, что в атомных структурах нет электронов, соответственно, нет и электронных сил. Тогда, на первый взгляд, показалось бы, что новые выводы отрекаются от всей предшествующей структуры мысли. Однако при более скрупулезном исследовании видно, что, как таковым, электронам действительно придана недействительная роль в большинстве объяснений физических и химических явлений, объяснений, полученных из электронной теории. Теория пользуется только числовыми значениями. Например, выводы, сделанные на основании положений элементов в периодической таблице, сейчас выражаются в терминах числа электронов. В условиях “насыщения” углерод обладает валентностью 4, потому что имеет в своей структуре 4 электрона; так гласит электронная теория. Из эмпирического свидетельства, очевидно, что в атоме углерода действительно имеются четыре некоего вида единицы, в то время как атом натрия имеет только одну такую единицу. Но эмпирические наблюдения не дают нам ничего кроме чисел 4 и 1; они ничего не говорят о природе единиц, к которым относятся числовые значения. Вывод, что эти единицы являются электронами, - чистое допущение, а отождествление с электронами не играет никакой роли в применении теории. 4 – это максимальная валентность углерода, а не число электронов. Еще один пример - Закон Мозли, соотносящий характеристические частоты спектра элементов с их атомными номерами. Сейчас этот закон принимается как “некое доказательство” существования определенного количества электронов в атомах элементов. Те же выводы делаются и на основании оптических спектров. В публикации Национального Бюро Стандартов, озаглавленной Энергетические уровни атома, мы обнаруживаем позитивное утверждение: “Каждый химический элемент может испускать столько атомных спектров, сколько у него электронов”.69 На самом же деле, в обоих случаях эмпирическое свидетельство не говорит ни о чем кроме чисел. И вновь, наблюдения говорят об определенных количествах единиц, но не указывают на природу этих единиц. И до тех пор, пока мы рассуждаем лишь на основании эмпирической информации, это могут быть единицы любого вида, без ограничения. Отказываясь от электронной теории в связи с этими явлениями, мы не совершаем никакого важного изменения; мы просто изменяем язык, которым выражаем свое понимание явлений. Вместо того чтобы сказать, что натрий имеет 11 электронов, один из которых пребывает в определенной “конфигурации”, на основании наших теоретических выводов мы говорим, что общее число единиц действующего смещения скорости в движениях вращения атома натрия составляет 11 единиц, и что лишь одна из них относится к электрическому (одномерному) вращению. В движениях вращения углерод обладает 6 единицами общего смещения, 4 из которых находятся в электрическом измерении. Из этого следует: в свойствах, обусловленных общим действующим смещением скорости (результирующему общему количеству движения в атоме), число, относящееся к натрию, составляет 11, а к углероду – 6. В тех свойствах, которые определяются смещением в электрическом измерении, соответствующими числами являются 1 для натрия и 4 для углерода. Перевести образование “ионных соединений” с языка электронной теории на язык СТОВ так же просто. Электронная теория гласит: устойчивость достигается приспособлением к “электронной конфигурации” одного из элементов инертного газа, и что, например, калий и хлор достигают этого за счет передачи одного электрона калия хлору. Таким образом, оба обретают статус элемента инертного газа аргона. СТОВ говорит: в электрическом измерении хлор обладает одной единицей отрицательного смещения скорости вращения (единицей движения во времени). Он может входить в химическое соединение только посредством относительной ориентации, при которой это отрицательное смещение уравновешивается в нулевой точке надлежащим положительным смещением. Калий обладает положительным смещением, величиной в 1 единицу, и соединение одной положительной единицы с отрицательной единицей хлора создает требующийся результирующий общий нуль. Как показывают вышеприведенные примеры, если рассматриваются лишь “ионные соединения”, СТОВ практически не меняет ничего кроме языка. Но если меняется язык, становится очевидно, что теория, относящаяся к одному ограниченному классу соединений, распространяется и на все реальные химические соединения. На этом основании нет необходимости в изобилии вспомогательных теорий, сформулированных для того, чтобы иметь дело с теми классами соединений, к которым не подходит базовое “ионное” объяснение. Вместо того чтобы прибегать к множеству разных “связей” (ионной связи, ионно-дипольной связи, ковалентной связи, водородной связи, трехэлектронной связи и многочисленным гибридным связям), требующихся для адаптации электронной теории ко многим видам соединений, СТОВ пользуется одними и теми же теоретическими принципами для всех соединений. В рассмотренных случаях перевод с языка электронной теории на язык СТОВ ведет к значительному прояснению механизма вовлеченных процессов. Если мы перестаем пользоваться электронной теорией, ни одна из ее величин не теряется; на другом языке она переносится в теоретическую структуру СТОВ. 68 Pauling, Linus, The Nature of the Chemical Bond, Cornell University Press, 1960, page 217. 69 См. например: Badger, G. M., The Structures and Reactions of the Aromatic Compounds, Cambridge University Press, 1954, Chapter 1. Глава 18. Простые соединения Ничего, кроме движения Глава 18: Простые соединения В предыдущих главах мы выделили определенные комбинации простых вращений, устойчивых в материальном секторе Вселенной, и отождествили каждую из комбинаций (в экспериментальной области) с наблюдаемой субатомной частицей или атомом элемента. Затем мы продемонстрировали, что в космическом секторе имеется точный дубликат системы материальных комбинаций вращения, но с переворотом пространства и времени. Также, все наблюдаемые частицы, не принадлежащие материальному сектору, мы определили как атомы или частицы космического сектора. Мы установили согласованность между теоретическими и наблюдаемыми структурами в той степени, в какой имеются данные наблюдений и экспериментов. Поскольку объем информации растет, у петли нет конца. Все наблюдаемые сущности соотнесены с теорией. В отношении ненаблюдаемых сущностей нам пока придется довольствоваться теоретическими объяснениями. Количество наблюдаемых частиц значительно увеличивается за счет общепринятой договоренности рассматривать частицы одного и то же вида, но с разными электрическими зарядами, как разные частицы. Сейчас мы не будем рассматривать действия электрических зарядов, поскольку существование зарядов не оказывает влияния на базовую структуру единицы. Заряды могут играть значимую роль при рассмотрении следующих вопросов: 1) будут ли происходить определенные виды реакций при определенных условиях; 2) влияют ли заряды на детали таких реакций; 3) может ли наличие, как таковое, или присутствие концентраций кинетической энергии оказывать материальное влияние на ход событий. Дело в том, что электрический заряд не является частью базовой структуры атома или субатомной частицы. Как выяснится при рассмотрении электрических явлений, относительно легко прибавляться или убираться может именно компонент времени. Следовательно, электрически заряженный атом или частица являются модифицированной формой первичной комбинации вращения, а не абсолютно другим видом структуры. Однако наше исследование базовых структур еще не завершено, поскольку имеются некоторые соединения определенных элементов, которые сопротивляются распаду и выступают как отдельные единицы в процессах с низкой или умеренной энергией. Такие соединения или молекулы играют очень важную роль в физической активности. И чтобы завершить исследование единиц, из которых состоят совокупности материи, сейчас мы займемся развитием теории структуры молекул и определим, какие виды молекул теоретически возможны. Концепция молекулы появилась из учения о поведении газов, и исходная формулировка была по сути эмпирической. Согласно исходному определению, в совокупности газа молекула является независимой единицей. Но такое определение не распространяется на твердые тела, поскольку независимой единицей в твердых телах обычно является индивидуальный атом или небольшая группа атомов. Поэтому в твердых телах молекула не обладает физической идентичностью. В целях расширения области применения концепции молекулы, скорее на теоретической, чем на эмпирической основе, ей дали новое определение. Как она понимается сейчас, молекула - это мельчайшая единица вещества, способная (теоретически) независимо существовать и сохранять все свойства вещества. Атомы молекулы удерживаются вместе межатомными силами, природа и величина которых будут детально исследоваться позже. Интенсивность действия межатомных сил не зависит от того, будут ли молекулы распадаться под действием разрушающих сил, и от влияния способа, как определенные атомы объединяются в молекулу. Как одни атомы могут объединяться с другими атомами, и в каких пропорциях обуславливается абсолютно другим набором факторов. Современная теория допускает, что факторы, отвечающие за межатомную силу или “связь”, обладают двойной функцией. Они определяют не только интенсивность силы сцепления, но и то, какая комбинация будет иметь место. Результаты современного исследования указывают на то, что сила, обуславливающая расстояние равновесия между двумя атомами, возникает одинаково и обладает идентичной характеристикой, невзирая на вовлеченные в процесс атомы и способность этих атомов принимать участие в формировании молекулы. Опыт свидетельствует о том, что было бы полезно подчеркнуть независимость вышеуказанных двух аспектов от межатомного взаимодействия. Исходя из этого, план представления, разработанный в первом издании, будет меняться. Как уже упоминалось, информация, связанная с молекулярной структурой, будет предоставляться до того, как будет предпринято исследование межатомных сил. Кроме того, преимущества использования знакомого термина “связь” для описания разных молекулярных структур перевешиваются тем, что термин “связь” почти неминуемо подразумевает обозначение какого-то вида силы. Поскольку разные молекулярные “связи” отражают относительные ориентации вращений взаимодействующих атомов, мы будем избегать употребления термина “связь” в этом смысле. В нынешних целях мы будем заменять его термином “ориентация”. В следующей главе термин “связь” будет использоваться в другом смысле, где будет действительно относиться к силе. Существование молекул, будь то комбинации определенного числа одинаковых атомов или химические соединения - комбинации разных атомов, - обуславливается ограничениями, связанными с межатомным равновесием. В свою очередь межатомное равновесие обуславливается существованием движения во времени в электрическом измерении атомов определенных элементов. Подобным ограничениям не подвергаются те элементы, атомы которых вращаются только в пространстве (положительное смещение во всех измерениях вращения), или способны обретать положительный статус посредством переориентации на основе 8 – x. Атом элемента такого вида может устанавливать равновесие с любыми другими атомами в любых пропорциях, хотя пропорции ограничиваются степенью влияния физических свойств вовлеченных элементов (точки плавления) или условий окружающей среды (температура). Материальные совокупности такого вида называются смесями. В некоторых случаях, если смеси однородны, а состав постоянен, используется термин сплав. Имеется класс интерметаллических соединений, в которых положительные составляющие комбинируются в определенных пропорциях. К соединениям такого класса относятся CuZn и Cu5Zn8. Комбинации меди и цинка не ограничиваются определенными отношениями, какими ограничивается состав реальных химических соединений. Коммерчески важные сплавы двух металлов занимают целую область, начиная с латуни (90% меди и 10% цинка) и кончая припоем (50% меди и 50% цинка). Вероятные сплавы выходят за рамки этих пропорций. Интерметаллические соединения – это такие сплавы, пропорции которых особенно благоприятны с геометрической точки зрения. В учебниках по химии типичное описание таково: “Теория сил сцепления, вовлеченных в интерметаллические соединения, очень сложная и еще не очень хорошо понята”. Причина в том, что в таких субстанциях нет “сил сцепления” в том смысле, в каком этот термин употребляется в связи с реальными химическими соединениями. Как было установлено, отрицательное вращение в электрическом измерении атома возможно по следующей причине: требование, чтобы общее результирующее смещение вращения было положительным (в материальном секторе), может удовлетворяться до тех пор, пока имеется положительное магнитное вращение. Однако в области времени внутри единицы расстояния электрические и магнитные вращения действуют независимо друг от друга. Существование случайно ориентированного электрического вращения во времени исключает сохранение фиксированного межатомного равновесия. Любое отношение пространства ко времени является движением, а движение нарушает равновесие. Однако в некоторых случаях равновесие может устанавливаться. Если два взаимодействующих атома ориентированы по линии взаимодействия так, что отрицательное смещение в электрическом измерении одного атома уравновешивается равным положительным смещением в одном из измерений второго атома так, тогда величина результирующего относительного движения равна нулю относительно естественного уровня. Или равновесие многоатомной группы может устанавливаться тогда, когда общие отрицательные смещения атомов с электрическим вращением во времени равны общим действующим положительным смещениям атомов, с которыми происходит взаимодействие. В таких случаях устанавливается равновесие, поскольку общее результирующее, положительное и отрицательное смещение равно нулю. В качестве альтернативы равновесие может основываться на 8 или 16 единицах, поскольку, как мы обнаружили, между одной нулевой точкой и другой имеются 8 единиц смещения. Отрицательное смещение x может уравновешиваться положительным смещением 8 – x, что в сумме дает 8 и является следующей нулевой точкой, эквивалентной исходному нулю. В качестве аналогии можно рассмотреть окружность, длина которой разделена на 8 равных частей. Любая точка на окружности может быть описана любым из двух способов: как x единиц от нуля по часовой стрелке или как 8 – x единиц от 8-ми против часовой стрелки. Расстояние 8 единиц от нуля по часовой стрелке эквивалентно нулю. Следовательно, равновесие между x и 8 – x со средней точкой в положении 8 эквивалентно равновесию между x и –x со средней точкой в положении нуля. Аналогичная ситуация возникает и в случае внутриатомного равновесия пространства-времени. До тех пор, пока относительное смещение двух взаимодействующих движений (результирующая двух индивидуальных величин) равно эквиваленту любой из нулевых точек, система пребывает в равновесии. Из-за особых требований к установлению равновесия компоненты комбинаций такого вида - молекулы химических соединений - существуют в определенных пропорциях. Каждые n атомов одного компонента связаны с определенным числом атомов другого компонента или компонентов. Помимо постоянных пропорций компонентов соединения отличаются от смесей или сплавов тем, что их свойства не обязательно подобны свойствам компонентов, что обычно справедливо для всех положительных комбинаций. Они могут обладать другой природой, поскольку результирующая равновесия пространства-времени требуемого характера может сильно отличаться от любой из действующих величин вращения индивидуальных элементов. Смещение вращения в измерении взаимодействия определяется объединенным “могуществом” или валентностью элемента. Поскольку отрицательное смещение является инородным компонентом материальной молекулы и для соединения должно уравновешиваться надлежащим положительным смещением, отрицательная валентность элемента – это число единиц действующего отрицательного смещения, которым обладает атом этого элемента. Из этого следует (с некоторыми возможными исключениями, которые будут обсуждаться позже), что у каждого элемента существует лишь одна величина отрицательной валентности. В любой определенной ориентации положительная валентность атома – это число единиц отрицательного смещения, которые могут нейтрализоваться, будучи ориентированы таким образом. Следовательно, каждый элемент обладает числом возможных положительных валентностей в зависимости от смещений вращения и разных способов их ориентации. Наличие альтернативных ориентаций во многом зависит от положения элемента внутри вращающейся группы. Готовясь к продолжению обсуждения этой темы, было бы желательно разработать классификацию в связи с положением элемента. Внутри каждой вращающейся группы у элементов первой половины группы минимальное электрическое смещение положительное, а у элементов второй половины группы - отрицательное. Поэтому для соответствующих половин мы будем пользоваться терминами “электроположительный” и “электроотрицательный”. Однако следует понимать, что подобное деление основано на следующем принципе: самая вероятная ориентация в электрическом измерении, рассматриваемом независимо, - это ориентация, возникающая в результате минимального смещения. Из-за молекулярной ситуации в целом электроотрицательный элемент часто действует как электроположительный. Конечно, при некоторых условиях почти все электроотрицательные элементы играют положительную роль в химических соединениях, а многие поступают так при всех условиях; это не влияет на разработанную классификацию. Также важные различия имеются между поведением первых четырех членов каждых серий положительных и отрицательных элементов и элементов с более высокими смещениями вращения. Поэтому мы будем делить каждую серию на нижнее деление и верхнее деление так, чтобы элементы с похожими общими характеристиками рассматривались вместе. Классификация будет основываться на величине смещения, причем в каждом случае нижнее деление будет включать элементы со смещениями от 1 до 4 включительно, а верхнее деление – от 4 и выше. Элементы со смещениями 4 принадлежат обоим делениям, поскольку способны действовать либо как самые высокие члены нижних делений, либо как самые низкие члены верхних делений. Следует осознать, что в электромагнитных сериях члены нижних делений обладают более высоким общим результирующим, положительным смещением (более высоким атомным номером). В целях удобства деления внутри каждой вращающейся группы будут нумероваться в порядке увеличения атомного номера следующим образом:
Эти деления приводились в пересмотренной таблице в главе 10. Как будет видно из последующего обсуждения, деление, к которому принадлежит элемент, обладает важным влиянием на его химическое поведение. Включение делений в таблицу значительно увеличивает объем предоставляемой информации. При всех прочих равных обстоятельствах, если нормальное смещение x превышает 4, эквивалент смещения 8 – x численно меньше, чем x, и, следовательно, более вероятен. Одно из следствий вероятности – предоставление положительной валентности 8 – x преимущества над отрицательной валентностью в Делении III, и, таким образом, ограничение отрицательных компонентов химических соединений до элементов Деления I, кроме одного случая, когда элемент Деления III обретает статус Деления IV по причинам, которые будут обсуждаться позже. Если положительный компонент соединения является элементом Деления I, нормальное положительное смещение этого элемента пребывает в равновесии с отрицательным смещением элемента Деления IV. В таком случае оба компонента ориентированы в соответствии с их нормальными смещениями. То же справедливо, если оба компонента двойные или множественные. Поэтому мы будем называть это нормальной ориентацией. Соответствующие нормальные валентности - это положительная валентность (x) и отрицательная валентность (-x). Теоретически, любой элемент Деления I может вступать в соединение с любым элементом Деления IV на основании нормальных валентностей. И все такие соединения должны быть устойчивыми при благоприятных условиях. Но будет ли любое определенное соединение такого типа устойчивым или нет в обычных земных условиях, определяется соображениями вероятности. Точная оценка вероятностей еще не произведена, но, представляется, что одним из главных факторов ситуации является общий принцип: нижнее смещение вероятнее, чем верхнее. Если мы сверим теоретически возможную нормальную валентность соединений с соединениями, перечисленными в учебнике по химии, в списке простых соединений мы обнаружим почти все нижние положительные – нижние отрицательные комбинации. Нижние положительные – верхние отрицательные и верхние положительные – нижние отрицательные комбинации представлены гораздо менее полно, а верхние положительные – верхние отрицательные комбинации и вовсе редки. Еще один главный фактор – геометрическая симметрия создающейся кристаллической структуры. Например, бинарное соединение четырех двухвалентных элементов (RX) вероятнее, чем соединение четырехвалентного и трехвалентного элементов (R3X4). Влияние обоих факторов вероятности ярко выражено в Делении II, где смещения, соответствующие нормальной валентности, обладают относительно высокими величинами 5 или больше. Отсюда, в этом Делении такая валентность используется лишь в ограниченной степени и обычно заменяется одной из альтернативных валентностей. Поскольку основное требование к образованию химического соединения – нейтрализация отрицательного электрического смещения, альтернативные, положительные валентности – это результаты разных способов ориентации вращения атома с целью достижения действующего положительного смещения. Ввиду того, что каждый вид валентности соответствует определенной ориентации, последующее обсуждение будет проходить в терминах валентности, и в каждом случае будет подразумеваться наличие соответствующей ориентации. Преобладающая валентность Деления III основывается на балансировании смещения 8 – x (положительного из-за переворота нулевой точки) со смещением отрицательного компонента. Результирующее относительное смещение равно 8, что, как объяснялось раньше, эквивалентно нулю. Мы будем называть его нейтральной валентностью. Нейтральная валентность играет важную роль в соединениях элементов Деления IV. В верхней части Делении III члены групп 4А и 4В не могут пользоваться нейтральной валентностью 8 – x потому, что у этих элементов величины 8 – x меньше нуля, и, следовательно, незначимы. Такие элементы образуют соединения на основании следующего более высокого эквивалента нулевого смещения. Между уровнем 8 – x и следующим эквивалентом нуля имеются две действующие первичные единицы движения и 8-единичное приращение. Таким образом, в этой точке общее действующее смещение равно 18, а вторичная, нейтральная валентность равна 18 – x. Типичными сериями соединений, пользующихся этой валентностью, являются окиси элементов группы 4А Деления III - HfO2, Ta2O5, WO3, Re2O7 и OSO4. Соображения симметрии благоприятствуют балансированию двух электрических смещений и, если позволяют условия, сведению их к необходимому равновесию пространства-времени. Но если электрическая ориентация в целом сталкивается с трудностями, в межатомном равновесии может играть положительную роль одно из магнитных вращений. Магнитные валентности, использующиеся в магнитно-электрических ориентациях – самая обычная основа комбинаций в Делении II, где положительные валентности высокие, а нейтральные исключены потому, что смещение 8 – x отрицательное. Если позволяют соображения вероятности, магнитные валентности появляются и в трех других делениях. Каждый элемент обладает двумя магнитными вращениями и, следовательно, двумя вероятными магнитными валентностями первого порядка. В альтернативных группах, если не вмешиваются влияния окружающей среды, оба вращения равны. На этом основании в половине групп число магнитных валентностей сводится к 1. Однако как мы видели в обсуждении вращения атома в главе 10, любой элемент может вращаться с прибавлением положительного электрического смещения вращения к магнитному вращению и с прибавлением отрицательного электрического смещения вращения к следующему более высокому магнитному вращению. Вследствие такой гибкости ограничение элементов альтернативных групп до элементов с магнитной валентностью 1 относится только к элементам Деления I. Здесь ограничение не имеет никакого реального значения, поскольку в любом событии элементы этого деления мало пользуются магнитной валентностью из-за высокой вероятности нижних положительных валентностей. Чтобы отличить две магнитные валентности друг от друга, мы будем называть большую из них первичной валентностью, а меньшую – вторичной магнитной валентностью. Ни одна из валентностей не обладает вероятностным преимуществом над другой, но значительное влияние оказывают ранее упомянутые соображения геометрии. Например, если магнитная валентность может быть либо 2, либо 3, комбинация с трехвалентным, отрицательным элементом принимает форму R3X2, если магнитная валентность равна 2, и форму RX, если превалирует альтернативная валентность. Форма RX более симметричная и, отсюда, более устойчивая структура. И наоборот, если отрицательный элемент обладает валентностью 4, структура R2X, образовавшаяся на основе магнитной валентности 2, симметричнее, чем структура R4X4, возникающая, если магнитная валентность равна 3. Следовательно, первая обладает преимуществом. Многие из теоретически возможных соединений магнитной валентности, пребывающие на границе устойчивости и не возникающие как независимые единицы, устойчивы в соединении с некоторыми другими комбинациями валентности. Например, имеются три теоретически возможные окиси углерода с валентностью первого порядка: CO2 (положительная электрическая валентность), CO (первичная магнитная валентность) и C2O (вторичная магнитная валентность). Первые две - простые соединения, а C2O нет. Имеется и еще одно хорошо известное соединение C3O2, которое, очевидно, является комбинацией CO C2O. Как мы увидим позже, способность менее устойчивых комбинаций участвовать в сложных структурах играет важную роль в сложных образованиях. Элементы с валентностью первого порядка (уже обсужденной валентностью) сведены в Таблицу 7. На основании этих валентностей формируется огромное большинство реальных химических соединений. ТАБЛИЦА 7 ВАЛЕНТНОСТИ ПЕРВОГО ПОРЯДКА
Имеется и альтернативный вид межатомной ориентации, создающий то, что мы называем валентностями второго порядка. Как подчеркивалось в предыдущем обсуждении, равновесие между положительными и отрицательными смещениями вращения может иметь место лишь тогда, когда общая результирующая равна нулю или эквиваленту нуля, потому что любая величина отношения пространства-времени, отличная от единицы (нулевое смещение), создает движение и исключает положения фиксированного равновесия. При самом вероятном условии начальный уровень, с которого начинается каждое вращение – это та же нулевая точка или, если природа ориентации требует других нулевых точек, самая ближайшая комбинация, возможная при таких обстоятельствах. Ясно, что основа валентностей первого порядка самая вероятная, но не единственная. Ввиду того, что разделение между естественными нулевыми точками (уровнями единицы скорости) составляет две линейных единицы (или 8 трехмерных единиц), можно создать равновесие, при котором первичный уровень положительного вращения (положительный нуль) отделен от первичного уровня отрицательного вращения (отрицательный нуль) двумя линейными единицами. Влияние такого разделения на валентность иллюстрирует Рис. 2. Рисунок 2 (а) (b) (c)
Основа валентностей первого порядка показана в графе (а). Здесь нормальная положительная валентность V уравновешивается равной отрицательной валентностью V в точке равновесия, представленной двойной линией. В графе (b) начальный уровень положительного вращения смещен к следующей нулевой точке, находящейся на расстоянии двух единиц от точки равновесия. Пребывая на положительной стороне точки равновесия, эти две единицы прибавляются к действующему положительному смещению, поэтому положительная валентность увеличивается до V + 2; то есть, единицы валентности V + 2 уравновешены. В графе (с) показан начальный уровень отрицательного вращения, тоже смещенный от точки равновесия. Здесь две промежуточные единицы прибавляются к действующему отрицательному смещению, и положительная валентность уменьшается до V – 2, поскольку V единиц положительного смещения способны уравновешивать лишь V – 2 единиц отрицательной валентности. При наличии модификаций нулевой точки, показанных на Рис. 2 (b), каждая положительная валентность первого порядка соответствует валентности второго порядка, мы будем называть ее усиленной валентностью. То есть, в случае прямых валентностей она на две единицы больше (x + 2), а у инверсивных валентностей – на две единицы меньше 8 – (x + 2) = 6 - x. Соединения, основанные на усиленных валентностях относительно необычны, поскольку высокой степенью вероятности обладает сама нормальная валентность, а усиленная валентность не только менее вероятна, но и обладает более высоким действующим смещением в любом конкретном применении, что еще больше уменьшает относительную вероятность. Факторы вероятности более благосклонны к усиленной нейтральной валентности, поскольку в этом случае действующее смещение меньше, чем действующее смещение соответствующих валентностей первого порядка. Поэтому соединений такого типа гораздо больше. Они включают такие хорошо известные вещества как SO2 и PCI3. Интересное использование этой валентности обнаруживается в озоне - окиси кислорода, аналогичной SO2. Теоретически, валентности могут ослабляться посредством ориентации по способу, показанному на Рис. 2. Но действительно ли соединения формируются на основе ослабленных электрических валентностей, весьма сомнительно. Причина их отсутствия еще не понята. Магнитные валентности могут быть как усиленными, так и ослабленными. Первичные и вторичные валентности могут модифицироваться, но поскольку усиление идет в направлении более низкой вероятности (большей числовой величины), количество обычных соединений, основанных на усиленных магнитных валентностях, относительно невелико. Ослабление валентности увеличивает вероятность, поэтому соединения с ослабленной валентностью изобильны в тех группах вращения, в которых они возможны (соединения с первичными магнитными валентностями больше 2). Список таких соединений еще очень умеренный по сравнению с количеством соединений, основанных на валентностях первого порядка. Как указывалось раньше, один компонент любого реального химического соединения может обладать отрицательным смещением 4 или меньше, поскольку такое соединение возникает лишь посредством установления равновесия между отрицательным и положительным смещением. Элементы с требующимся отрицательным смещением составляют Деление IV. Из этого следует: каждое соединение должно включать, по крайней мере, один элемент Деления IV или элемент, обретающий статус Деления IV посредством усиления валентности. Если имеется лишь один такой компонент, положительно-отрицательная ориентация фиксирована, поскольку элемент Деления IV – это обязательно отрицательный компонент. Однако если к Делению IV относятся оба компонента, тогда один обычно отрицательный компонент вынужден переориентироваться так, чтобы выступать в роли положительного смещения. Но тогда возникает вопрос сохранения его отрицательного статуса. Ответ на этот вопрос тесно связан с относительной отрицательностью рассматриваемых элементов. Очевидно, меньшее смещение отрицательнее, чем большее, поскольку последнее находится дальше от нейтральной точки, в которой положительные и отрицательные смещения равной величины эквивалентны. Внутри любой группы порядок отрицательности такой же, как в последовательности смещения. Например, в группе 2В самый отрицательный элемент – хлор, за ним идут сера, фосфор и кремний именно в таком порядке. Это значит, что в любой комбинации хлор-сера Деления IV, отрицательный элемент - хлор, а результат - соединение SCI2, а не CIS или CI2S. С другой стороны, поскольку обычно фосфор положителен к сере, имеется соединение Р2S3. Если электрические смещения равны, элемент с меньшим магнитным смещением отрицательнее, поскольку действие большего магнитного смещения разбавляет отрицательное электрическое вращение за счет распределения на большее общее смещение. Поэтому мы находим CIF3 и CIBr3, а не FCI3 или BrCI3. Степень изменения отрицательности за счет разницы в магнитном смещении значительно меньше, чем степень изменения, возникающая в результате неравенства электрического смещения. Поэтому неравенство электрического смещения является контролирующим фактором, кроме тех случаев, когда электрические смещения обоих компонентов одинаковы. На основании вышеизложенного все элементы Деления I, II и III положительны к элементам Деления IV. Смещение 4-х элементов на границе между Делениями III и IV принадлежит более высокому делению, если комбинируется с элементами более низкого смещения. Если элементы, расположенные ниже в отрицательных сериях, обретают валентности 4 или больше посредством усиления или переориентации, они обретают свойства Деления III и становятся положительными к другим элементам Деления IV. Поэтому хлор, отрицательный к кислороду в соединении OCI2 в Делении IV, становится положительным компонентом в соединении CI2O7. Аналогично, обычные отношения фосфора и серы, как они существуют в P2S3, переворачиваются в S3P4, где сера обладает валентностью 4. Как и смещение 4-х членов высших групп, водород – пограничный элемент, и за счет своего положения способен принимать либо положительные, либо отрицательные характеристики. Поэтому он положителен ко всем чисто отрицательным элементам (Деление IV ниже валентности 4), но отрицателен ко всем строго положительным элементам (Деления I и II) и к элементам Деления III. Из-за низкого магнитного смещения он отрицателен и к более высоким пограничным элементам - углероду, кремнию и так далее. Тот факт, что водород отрицателен к углероду, особенно значим в свете важности комбинации углерод-водород в органических соединениях. Еще одно положение, которое следует отметить: если водород действует с положительным смещением, он делает это как элемент Деления III, а не как член Деления I. Следовательно, его магнитная валентность равна +1. Вот почему в пересмотренной периодической таблице водород помещен лишь в отрицательное положение, а не в два привычных положения. Изменение отрицательности в зависимости от величины магнитного смещения обладает эффектом расширения поведения элементов Деления III в поведение элементов Деления IV и, в некоторой степени, в более высокие группы. Например, свинец практически не обладает характеристиками Деления IV, а висмут имеет меньше дубликатов в более низких группах. На нижнем конце атомных серий ситуация переворачивается. И характеристики поведения элементов Деления IV расширяются на поведения элементов Деление III как альтернатива нормальному положительному поведению некоторых элементов этого Деления. Например, кремний образует не только такие комбинации, как MnSi или CoSi3 (которые, согласно имеющейся сейчас информации, появляются в виде интерметаллических соединений, подобных соединениям высших элементов Деления III), но и Mg2Si и CaSi2, которые, возможно, являются реальными соединениями, аналогичными Be2C и CaC2. Углерод продолжает эту тенденцию еще дальше и образует карбиды с широким разнообразием положительных компонентов. В группе 2А Деления IV характеристики поведения расширяются до поведения пятого элемента – бора. Это единственный случай, когда пятый элемент серий обладает свойствами Деления IV. Поэтому поведение бора при формировании соединений уникально. Обладая валентностью Деления I, в качестве положительного компонента в таких соединениях, как В2О3, бор абсолютно обычен. Однако первый порядок его отрицательной валентности равен (–5). Образование соединений, основанных на валентности (-5), конфликтует с ранее установленным ограничением отрицательной валентности - максимум 4 единицы. Поэтому бор сдвигается в усиленную отрицательную валентность, прибавляя к величине первого порядка (-5) две положительные единицы, что в итоге дает (-3). Прямые комбинации бора с положительными элементами – это такие структуры как FeB и Cu3B2. Однако многие бориды обладают сложными структурами, в которых действующие валентности определены не так явно. Тогда возникает вопрос: Может ли бор быть исключением из правила, ограничивающего максимальную, отрицательную валентность до (-4)? И может ли он пользоваться валентностями (-5) и (-3)? Эта проблема будет рассматриваться в следующей главе. Глава 17. Некоторые умозрительные построения Ничего, кроме движения Глава 17: Некоторые умозрительные построения СТОВ состоит из фундаментальных постулатов и всего, что подразумевается в постулатах; то есть, из всего, что может быть выведено из этих постулатов посредством логических и математических процессов, без введения чего-то из любого другого источника. По определению, это теория, претендующая на то, чтобы быть истинным и точным представлением наблюдаемой физической Вселенной, на основаниях, определенных на предыдущих страницах. Выводы, изложенные в этой и других публикациях автора и других - это результаты усилий, направленных на детальное развитие следствий постулатов. Результаты, появившиеся на ранних фазах теоретического развития, призывают к радикальным модификациям превалирующих концепций о природе некоторых базовых физических сущностей и явлений. Совершить такие модификации нелегко; их осуществление затрудняется навыками мышления не только читателей этих трудов, но и самих исследователей. Им трудно уловить полные следствия новых идей, когда они появляются впервые. Наглядный пример - существование скалярного движения в более чем одном измерении, которое играет важную роль в двух предыдущих главах. Сейчас ясно, что такое движение – необходимое и неизбежное следствие базовых постулатов; и нет препятствия, стоявшего на пути полного и детального понимания его природы и эффектов, если бы их можно было рассматривать независимо от влияния ранее существующих идей и убеждений. Но чисто по-человечески, это невозможно. Умы, в которые входит эта идея, привыкли думать совсем другим образом; а инерция мысли подобна инерции материи в том, что ее можно преодолеть лишь через какой-то период времени. Даже простая концепция движения, скалярного, а не векторного (векторные аспекты отбрасываются), представляет собой немалое концептуальное изменение. И первое издание труда не поднялось выше этого положения, кроме выявления того, что увеличение скорости разбегания галактик линейно выше подразумеваемого допускаемого “гравитационного предела”, и что это приращение скалярное. Последующие изучения высоко энергетических астрономических явлений продвинули понимание еще на один шаг вперед, поскольку привели к выводу, что квазары движутся в двух измерениях. Дополнительное время потребовалось на признание того факта, что единица скалярной скорости в трех измерениях является демаркационной линией между областью движения в пространстве и областью движения во времени. Первой публикацией, в которой конкретно обсуждалось это положение, был труд Квазары и пульсары (1971). Сейчас мы находим, что те же соображения распространяются и на входящие космические частицы. Представляется, что сейчас тема раскрыта в полном объеме, но прошлый опыт не поддерживает такое позитивное утверждение. Опыт демонстрирует, как трудно достичь исчерпывающего понимания разных аспектов любой новой информации, выведенной из базовых постулатов. Это объясняет, почему определение источника, из которого можно получить правильные ответы, автоматически не предоставляет все ответы. И почему результаты, полученные посредством применения СТОВ как продукты еще одного исследования в ранее неизвестных областях физики, обязательно отличаются по степени определенности, которая может приписываться результатам, особенно на относительно ранних стадиях исследования. Многие результаты пребывают выше разумного сомнения, другие можно лучше всего характеризовать как “незавершенную продукцию”, третьи являются не более чем умозаключениями. Из-за крайне критичной проверки, которой привычно (и здраво) подвергается теория, базирующаяся на новой и радикально непохожей концепции, публикация результатов теоретического развития, описанных в этой работе, была ограничена темами, прошедшими долгое и скрупулезное исследование и обладающими очень высокой степенью вероятности быть корректными. Почти тридцать лет изучения и исследования вылились в проект еще до того, как было опубликовано первое издание. Дополнения и изменения в новом издании - это результат еще двадцати лет рассмотрения и расширения оригинальных выводов автором и другими. Ввиду того, что результаты развития представляют собой выводы о единой Вселенной, полученные из единого набора базовых допущений, каждое продвижение в понимании явлений в одной области физики проливает свет на насущные вопросы в других областях. Пересмотр, потребовавшийся для подготовки нового издания, включает все продвижения, достигнутые после последнего предыдущего систематического изучения каждой области. Значительное прояснение ранее исследованной темы и распространение теории на новые области почти автоматически сопровождались пересмотром текста. Если было очевидно, что новые теоретические выводы в достаточной степени удовлетворяют критериям, предъявляемым к первому изданию, они включались в новое издание. Но, в целом, любые новые идеи, ведущие к большим последствиям и появившиеся из довольно беглого просмотра, подвергались дальнейшему изучению для уверенности в том, что они получают адекватное рассмотрение до публикации. В одном конкретном случае имеется достаточное оправдание для отхода от общей политики. На предыдущих страницах обсуждение распада космических элементов после входа в материальное окружение было доведено до момента завершения распада. Отмечалось, что результатом обязательно было бы преобразование космических элементов в формы, совместимые с новой окружающей средой. Поскольку водород является превалирующей составляющей материального сектора вселенной, этот элемент должен создаваться непосредственно из продуктов распада. Но осталось теоретически неясным, как происходит это преобразование, а эмпирической информации на эту тему практически не существует. Если бы этот пробел был заполнен, это стало бы значимым продвижением к завершению базовой теоретической структуры. Рассмотрение вопроса в период подготовки текста нового издания выявило некоторые интересные возможности, и обсуждение новых идей в этом издании представляется оправданным. Хотя следует признать, что они представляют собой умозаключения или, по крайней мере, “незавершенную продукцию”. Первый из пробных, новых выводов таков: нейтрино-мюон не является нейтрино. На нынешней стадии развития теории нет места любым нейтрино, кроме нейтрино-электрона и его космического аналога – антинейтрино-электрона, как он сейчас известен. Конечно, дверь не запечатана. Ранее в этом томе допускалось наличие имеющегося свидетельства, демонстрирующего, что физическая Вселенная – это на самом деле Вселенная Движения, и что правильное развитие следствий постулатов, определяющих такую Вселенную, будет давать точное представление о существующей физической Вселенной. Однако это не залог того, что автор и его помощники непогрешимы, и что выводы, к которым они пришли, всегда верны. Дальнейшее теоретическое прояснение может изменить некоторые аспекты существующей точки зрения на ситуацию нейтрино, но в теории, как она выглядит сейчас, нет места для нейтрино-мюонов. Как говорилось на предыдущих страницах, теория не требует появления другой безмассовой частицы в процессах, в которых сейчас появляется “нейтрино-мюон”. Логическим выводом является то, что частица, сейчас называемая нейтрино-мюоном, - это частица, требуемая теорией - безмассовый нейтрон. На первый взгляд это ничто иное, как изменение названия, поскольку две безмассовые частицы нельзя различить никакими ныне известными способами. С точки зрения теории наблюдаемая частица очень хорошо удовлетворяет теоретическим выводам о поведении безмассового нейтрона. Теоретически, эта частица должна возникать в каждом событии распада, в то время как нейтрино появляется лишь на последнем шаге - разделении оставшегося космического атома на две безмассовые частицы. Это соответствует наблюдению, поскольку “нейтрино-мюон” появляется как при распаде пиона, так и при распаде мюона, в то время как нейтрино-электрон появляется только при распаде мюона. Эмпирическое подтверждение теоретически выведенного “лиона” безмассовых нейтронов на ранних процессах распада еще не получено, но это понятно. Зафиксированные продукты распада положительного мюона тоже согласуются с гипотезой безмассового нейтрона. Считается, что эти продукты являются позитроном (согласно нашим результатам) М 0-0-1, нейтрино-электроном М 2-2-(1) и “антинейтрино-мюоном”, который сейчас мы определяем как безмассоый нейтрон М 2-2-0. Позитрон и нейтрино-электрон вместе эквивалентны второму безмассовому нейтрону. Их появление как двух, а не одной частицы, возможно, происходит за счет того, что они являются продуктами конечного преобразования оставшегося космического атома, в котором электрические и магнитные вращения совершаются в противоположном направлении, а не отдельными частицами, испущенными из космического атома. Сообщают, что мюоны существуют и с отрицательными зарядами, и что они распадаются на античастицы продуктов распада положительного мюона - электрон, антинейтрино-электрон и “нейтрино-мюон”. Эти продукты эквивалентны двум космическим безмассовым нейтронам. Появление этих частиц или космических частиц любого вида, иных, чем члены обычной последовательности распада, в результате процесса распада, довольно трудно примирить с разработанными теоретическими принципами. Теоретические соображения указывают на то, что нет такой вещи как “антимезон”, и что отрицательно заряженный мюон идентичен положительно заряженному мюону, кроме разницы в заряде. На этом основании продукты распада должны отличаться только тем, что электрон заменяет позитрон. Ввиду того, что в каждом случае две частицы распада не наблюдаются, это указывает на вероятность того, что их определение в современной физической мысли исходит из 90% интерпретации и 10% наблюдения, входящего в зафиксированные результаты. Именно существование нерешенных вопросов такого рода вызывает необходимость характеризовать содержание этой главы как некоторое умозрительное построение. На основании теоретического паттерна распада входящие космические атомы со временем преобразовываются в безмассовые нейтроны и их эквиваленты. Тогда возникает проблема: что происходит с этими частицами? На этом пути нет никаких экспериментальных или наблюдательных указательных столбов, поэтому мы будем полностью зависеть от теоретических выводов. Безмассовый нейтрон уже обладает структурой материального типа, то есть, отрицательным и положительным вращением; поэтому никакого процесса преобразования не требуется. Невозможны ни распад, ни фрагментация, потому что эта частица обладает лишь одной единицей смещения вращения. Следовательно, движение водорода к цели должно происходить с помощью дополнительных процессов. Прибавление безмассового нейтрона к позитрону, протону, сложному нейтрону или второму безмассовому нейтрону должно создавать частицу, обладающую одной системой смещения вращения - 2 (на шкале частиц). Как указывалось в главе 11, представляется, что такая частица, если вообще существует, нестабильна. В отсутствии любых средств передачи одной из единиц смещения второй системе вращения неустойчивая частица будет распадаться на частицы первичных видов. Следовательно, такие дополнения ничего не дают. Реально возможные прибавления образуют обычные серии. Продукт распада - безмассовый нейтрон М ½-½-0 - может соединяться с электроном М 0-0-(1) для формирования нейтрино М ½-½-(1). Другой безмассовый нейтрон, прибавленный к нейтрино, создает протон М 1-1-(1). Как указывалось, прибавление безмассового нейтрона к протону невозможно, но можно прибавить нейтрино, а это создает массу одного изотопа водорода М ½-½-(2). Коль скоро нас интересует смещение вращения, сейчас у нас имеется ясная и последовательная картина. С помощью безмассовых нейтронов, возникающих при распаде космических лучей на электроны и нейтрино (частицы, в изобилии имеющиеся в материальном окружении), создается водород – базовый элемент в материальном секторе. Но здесь присутствует один важный фактор, который следует принять во внимание. С прибавлением безмассового нейтрона к электрону, проблем нет, но при прибавлении нейтрино для создания протона требуется единица массы. Вопрос, на который следует ответить прежде, чем гипотетический процесс строительства водорода станет реальностью, таков: Откуда приходит требуемая масса? На основании последних теоретических разработок представляется, что ответ на этот вопрос можно найти в доныне неосознанном свойстве частиц с двумерным вращением. Как объяснялось в главе 12, масса обратная трехмерной скорости составляет t3/s3, а обратная одномерной скорости энергия равна t/s. Очевидно, существует промежуточная величина t2/s2, обратная двумерной скорости. Она определяется как момент или импульс, но не рассматривается как производное массы. Конечно, момент обычно определяется как произведение массы на быстроту. Не осознано то, что величина, обратная двумерной скорости, может существовать сама по себе, независимо от массы, и что двумерная безмассовая частица может обладать тем, что мы называем внутренним моментом t2/s,2 “аналогично тому, как трехмерный атом обладает массой” t3/s3. Внутренняя энергия атома - “энергия, эквивалентная массе” - равна произведению массы на квадрат единицы скорости t3/s3 x s2/t2 = t/s. Это отношение, открытое Эйнштейном и выраженное как E = mc2. Чтобы получить единицу массы, требующуюся для прибавления безмассового нейтрона к нейтрино для создания протона, следует обеспечить единицу количества энергии t/s. Кинетическая энергия частицы с внутренним моментом М – это произведение момента на скорость: Mv = t2/s2 x s/t = t/s. Ввиду того, что безмассовый нейтрон обладает единицей магнитного смещения и, следовательно, единицей момента, будучи безмассовым, он движется с единицей скорости (скорость света), и его кинетическая энергия равна единице. Таким образом, кинетическая энергия безмассового нейтрона равна энергии, требующейся для создания единицы массы. Входя в состояние покоя в стационарной системе отсчета, безмассовый нейтрон может обеспечивать энергию и смещение вращения, необходимые для создания протона посредством комбинации с нейтрино. И вновь (по крайней мере, на первый взгляд) представляется, что имеется полное и согласованное теоретическое объяснение преобразования продукта распада в материальный атом. Конечно, гипотетические процессы трудно подтвердить наблюдением. Поэтому, до лучших времен, выводы приходится делать исключительно на теоретических основаниях. Следует заметить, что на основании этих выводов водород создается из продуктов распада, непрерывно появляющихся в пространстве продолжений материального сектора потому, что популяция нейтрино должна распределяться равномерно. Это согласуется с другими выводами, обсуждавшимися в первом издании, и будет обсуждаться в дальнейшем в томе 2. Достоверность только что сделанных выводов значительно подкрепляется тем фактом, что в этом положении сходятся две развивающиеся теоретические линии. Как констатировалось раньше, втекание космической материи в материальный сектор уравновешивается испусканием материи из материального сектора в космический сектор в виде высокоскоростных продуктов взрыва. Непрерывная активность Вселенной обуславливается двумя важными фазами великого цикла. Важным, хотя и менее явным аспектом этого цикла является медленный процесс роста и развития, которому подвергается материя прежде, чем она будет готова к участию в событиях, испускающих ее назад в космический сектор и завершающих цикл. Поэтому одна из главных задач в развитии теории физической Вселенной на основании постулатов СТОВ - проследить эволюцию новой материи и совокупностей, образованных этой материей. При этом наша первая задача - определение участников физической активности и их основных свойств, потому что эта информация потребуется прежде, чем станет возможной точная оценка событий, в которых участвуют эти сущности. Сейчас, достигнув, по крайней мере, умозрительно, стадии водорода, мы отложим дальнейшее рассмотрение эволюции материи до тома 2 и вернемся к исследованию материальных единиц и их первичных комбинаций.
|
ТОП-10
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

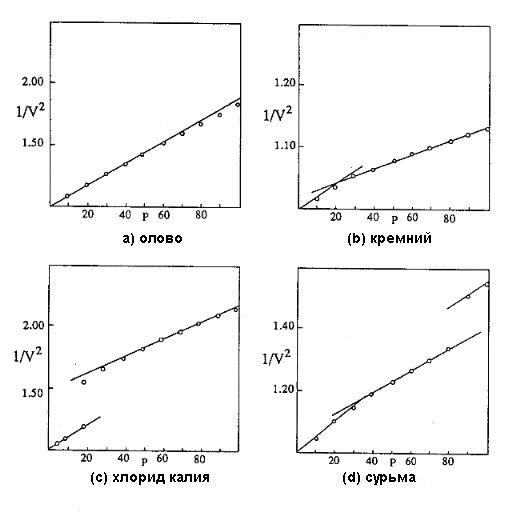


 Следующая страница
Следующая страница

 Линда Моултан-Хау: В поисках истины – 1
Линда Моултан-Хау: В поисках истины – 1